Порівняння ефектів тикагрелору та прасугрелю у пацієнтів із гострим коронарним синдромом: наскільки значимі результати дослідження ISAR-REACT 5 для реальної клінічної практики?Подвійна антитромбоцитарна терапія комбінацією ацетилсаліцилової кислоти (АСК) та інгібітора P2Y12-рецепторів є стандартом лікування пацієнтів з гострим коронарним синдромом (ГКС), при цьому відповідно до сучасних рекомендацій Європейського товариства кардіологів (ESC) з реваскуляризації міокарда 2018 року, у пацієнтів з ГКС перевагу мають прасугрель і тикагрелор (клас рекомендації I, рівень доказовості B), за винятком хворих після тромболізису та осіб, що отримують пероральні антикоагулянти, яким має призначатися клопідогрель [1]. Слід зазначити, що у хворих із ГКС без стійкого підйому сегмента ST застосування прасугрелю рекомендовано лише під час процедури черезшкірного коронарного втручання (ЧКВ) та якщо пацієнт раніше не отримував інгібітор P2Y12-рецептора; при цьому за невідомої коронарної анатомії використання прасугрелю не рекомендується. Навпаки, тикагрелор може використовуватися незалежно від попереднього лікування інгібітором P2Y12-рецептора та обраної стратегії лікування. Крім того, прасугрель у дозі 10 мг не рекомендується літнім людям (≥75 років), особам з низькою масою тіла (<60 кг); до того ж, будь-який інсульт або транзиторна ішемічна атака в анамнезі є прямим протипоказанням до застосування цього препарату [2, 3].
Ефективність прасугрелю та тикагрелору при ГКС Дані, що стали основою рекомендації ESC щодо переважного використання тикагрелору і прасугрелю у хворих з ГКС, були отримані в дослідженнях PLATO (Platelet Inhibition and Patient Inhibition and Patient Inhibition and Patient Inhibition Outcomes) для тикагрелору та TRITON-TIMI 38 (TRial to assess Improvement in Therapeutic Outcomes by optimising platelet inhibitioN with prasugrel – Thrombolysis In Myocardial Infarction 38) для прасугрелю [4, 5]. Обидва дослідження проводилися як міжнародні багатоцентрові рандомізовані подвійні сліпі та були спрямовані на порівняння ефективності нових антиагрегантів та клопідогрелю у профілактиці повторних серцево-судинних (СС) подій у пацієнтів з ГКС. У дослідження PLATO увійшли 18 624, а в TRITON-TIMI-38 – 13 608 пацієнтів з ГКС та показаннями до ЧКВ. Первинною кінцевою точкою в обох дослідженнях була комбінація інфаркту міокарда (ІМ), інсульту та смерті від СС причин. Тривалість періоду наступного спостереження становила 12 місяців у дослідженні PLATO (середній показник 277 днів) та 15 місяців у дослідженні TRITON-TIMI-38 (середній показник 9,5 місяця). У дослідженні PLATO частота первинної кінцевої точки становила 9,8% у групі тикагрелору та 11,7% у групі клопідогрелю (відношення ризиків [ВР] 0,84, 95% довірчий інтервал [ДІ] 0,77–0,92, p<0,001). Аналіз інших кінцевих точок ефективності показав, що у пацієнтів, які отримували тикагрелор, було досягнуте значне зниження СС смертності (4,0 vs 5,1%, ВР 0,79, 95% ДІ 0,69–0,91, р=0,001), а також частоти ІМ (5,8 vs 6,9%, ВР 0,84, 95% ДІ 0,75–0,95, р=0,005). При цьому в групі тикагрелору поряд зі зниженням ризику смерті від СС причин спостерігалося зменшення загальної смертності (4,5 vs 5,9%, ВР 0,78, 95% ДІ 0,69–0,89, р<0,001) і тенденція до зниження смертності від неСС захворювань (0,5 vs 0,8%, ВР 0,71, 95% ДІ 0,49–1,04, р=0,08). У дослідженні TRITON-TIMI-38 частота первинної кінцевої точки становила 9,9% у групі прасугрелю та 12,1% у групі клопідогрелю (ВР 0,81, 95% ДІ 0,73–0,90, р<0,001). Зниження частоти первинної кінцевої точки серед пацієнтів у групі прасугрелю в основному було пов‘язане зі зниженням частоти ІМ (7,3 vs 9,5%, ВР 0,76, 95% ДІ 0,67–0,85, р<0,001) без міжгрупових відмінностей за частотою смертей від СС причин (2,1 vs 2,4%, ВР 0,89, 95% ДІ 0,70–1,12, р=0,31), інсульту (1,0 vs 1,0% , ВР 1,02, 95% ДІ 0,71–1,45, p=0,93) і за загальною смертністю (3,0 vs 3,2%, ВР 0,95, 95% ДІ 0,78–1,16, р=0,64).
Безпека прасугрелю та тикагрелору Первинною кінцевою точкою безпеки у дослідженні PLATO була велика кровотеча (за критеріями дослідження), частота якої становила 11,6% у групі тикагрелору та 11,2% у групі клопідогрелю (ВР 1,04, 95% ДІ 0,95–1,13, p=0,43). Істотні міжгрупові відмінності за частотою великих кровотеч за критеріями TIMI (7,9 vs 7,7%, ВР 1,03, 95% ДІ 0,93–1,05, p=0,57) та комбінації загрозливих для життя та фатальних кровотеч (5,8 vs 5,8%, ВР 1,03, 95% ДІ 0,9–1,16, р=0,70) також були відсутні. Аналіз вторинних кінцевих точок безпеки показав значно більшу частоту великих кровотеч, не пов’язаних з аортокоронарним шунтуванням (АКШ), у групі тикагрелору (4,5 vs 3,8%, ВР 1,19, 95% ДІ 1,02–1,38, р=0,03). У дослідженні TRITON-TIMI-38 частота первинної кінцевої точки безпеки – не пов’язаних з АКШ великих кровотеч за критеріями TIMI – становила 2,4% у групі прасугрелю та 1,8% у групі клопідогрелю (ВР 1,32, 95% ДІ 1, 03–1,68, р=0,03). Також у групі прасугрелю частіше реєструвалися загрозливі для життя кровотечі (1,4 vs 0,9%, ВР 1,52, 95% ДІ 1,08–2,13, р=0,01), фатальні кровотечі (0,4 vs 0,1%, ВР 4,19, 95% ДІ 1,58–11,11, p=0,002), великі та малі кровотечі за критеріями TIMI (5,0 vs 3,8%, ВР 1,31, 95% ДІ 1,11–1,56, р=0,002), а також кровотечі, пов’язані з АКШ (13,4 vs 3,2%, ВР 4,73, 95% ДІ 1,90–11,82, р<0,001). Незважаючи на безперервне зростання використання прасугрелю і тикагрелору в клінічній практиці, ці препарати тривалий час не порівнювалися безпосередньо у великому рандомізованому клінічному дослідженні, а результати субаналізів клінічних досліджень, великі реєстри або мета-аналізи не дозволяли остаточно вирішити, який з цих двох препаратів більш ефективний у профілактиці несприятливих СС подій і більш безпечний при використанні у хворих з ГКС [6–14]. Першим клінічним дослідженням, проведеним для прямого порівняння ефективності та безпеки тикагрелору і прасугрелю у пацієнтів з ГКС, стало дослідження ISAR-REACT 5 (The Intracoronary Stenting and Antithrombotic Regimen: Rapid Early Action for Coronary Treatment 5) – рандомізоване багатоцентрове відкрите дослідження фази IV [15]. Результати дослідження показали перевагу прасугрелю над тикагрелором за впливом на частоту комбінованої кінцевої точки, що включає смерть, ІМ та інсульт, протягом року після рандомізації у пацієнтів з ГКС, яка не супроводжувалась підвищенням ризику кровотеч [16]. За наявними даними, кардіологічна спільнота в цілому очікувала від дослідження ISAR-REACT 5 дещо інших результатів, що стало підставою для критичного вивчення протоколу дослідження, у тому числі методів аналізу та досліджуваної вибірки, а також даних щодо проведення та результатів цього клінічного дослідження. Група польських вчених Ostrowska et al. стисло представили основні сумнівні моменти ISAR-REACT 5 у такий спосіб [17].

Аспекти, що обмежують практичне значення результатів ISAR-REACT 5 Мета ISAR-REACT 5 полягала у перевірці гіпотетичної переваги тикагрелору над прасугрелем у пацієнтів з ГКС, але фактично в ньому порівнювалися різні стратегії антитромбоцитарної терапії, які лише частково відповідають рекомендаціям ESC. Перш за все, пацієнти (n=4018) з ІМ з підйомом сегмента ST проходили рандомізацію на стаціонарному етапі лікування ІМ і до рандомизації не могли приймати ні прасугрель, ні клопідогрель, оскільки це суперечило критеріям набору в дослідження, і в результаті порушувалася рекомендація настанов з якнайшвидшого початку антиагрегантної терапії після надходження пацієнта з діагнозом ІМ. До того ж, пацієнти з підтвердженим діагнозом ГКС, у яких після коронарографії було обрано консервативну стратегію лікування, все рівно отримували призначений при рандомізації інгібітор рецептора P2Y12-рецепторів, хоча використання прасугрелю в цій ситуації суперечило інструкції щодо застосування. Крім того, протокол дослідження та особливості його організації призвели до потенційного зміщення вибірки, значимість якого погано подається оцінці. Зокрема, відкритий дизайн дослідження, рандомізація методом конвертів, загальна тривалість набору пацієнтів близько 5 років та факт проведення дослідження лише у двох країнах (21 центр у Німеччині та два в Італії) могли надати деякий, хоча, імовірно, незначний вплив на результати. Водночас привертає увагу вражаюче високий відсоток пацієнтів, які дотримувалися рекомендацій із застосування досліджуваного препарату, що становив 99,1% у групі прасугрелю та 99,6% у групі тикагрелору. Для порівняння, у спільній вибірці дослідження PLATO рівень дотримання рекомендацій становив 82,8% [4]. Наведені вище дані явно вказують на недооцінку випадків недотримання рекомендацій протоколу дослідження ISAR-REACT 5, особливо якщо врахувати переважно дистанційний характер візитів наступного спостереження (для 83% учасників це була оцінка під час телефонної розмови, для 7% – за листуванням, і лише 10% учасників приходили на візити наступного спостереження до лікарні чи поліклініки) [17]. На думку Ostrowska et al. сумніви в частоті недотримання режиму лікування, що становить 0,9% та 0,4%, посилюються, якщо врахувати, що після закінчення госпітального етапу пацієнт мав купувати препарат за власні кошти (без відшкодування). Крім того, ретельний аналіз вихідних характеристик обох досліджуваних груп показав, що в групі тикагрелору вихідний рівень ризику був дещо вищим, ніж у групі прасугрелю, хоча ці відмінності не були статистично значущими [17]. Використання вибірки всіх рандомізованих пацієнтів (intention-to-treat, ITT; аналіз проводиться з урахуванням лікування, призначеного при рандомізації, незалежно від фактично отриманої терапії) є стандартним підходом до аналізу даних у подібних клінічних дослідженнях. Однак у випадку з ISARREACT 5 такий підхід міг спотворити результати дослідження, оскільки 410 з 2012 (20,4%) пацієнтів у групі тикагрелору та 410 з 2006 (20,4%) пацієнтів у групі прасугрелю на момент виписки з лікарні не отримували інгібітор P2Y12-рецептора, призначений при рандомізації. Крім того, ще 243 (15,2%) пацієнти з групи тикагрелору та 199 (12,5%) із групи прасугрелю перестали приймати призначений антиагрегант після виписки зі стаціонару, при чому відміна тикагрелору відбувалась значно раніше, порівняно з прасугрелем (медіана 84 та 109 днів відповідно, р=0,01). І, нарешті, загалом 37 пацієнтів (19 та 18 пацієнтів у групі тикагрелору та прасугрелю відповідно, 0,92%) достроково вибули з-під наступного спостереження; для порівняння, у дослідженні TRITON-TIMI 38 цей показник становив 0,12%, а в дослідженні PLATO – 0,01% [4, 5]. Отже, ITT-підхід, що використовувався в дослідженні ISAR-REACT 5, привів до включення в остаточний аналіз ефективності 1299 пацієнтів, які не приймали призначений при рандомізації препарат у періоді наступного спостереження (у групі тикагрелору – 653 з 2012 учасників, 32,5%; у групі прасугрелю – 609 з 2006 учасників, 30,4%). За результатами дослідження події первинної комбінованої кінцевої точки (смерть, ІМ або інсульт) протягом року після рандомізації були зареєстровані у 184 з 2012 (9,1%) пацієнтів у групі тикагрелору та у 137 з 2006 (6,9%) пацієнтів у групі прасугрелю (ВР 1,36, 95% ДІ 1,09–1,70, р=0,006). Враховуючи, що до аналізованої вибірки з участю 4018 пацієнтів увійшли 1262 особи (31,4%), які фактично не отримували призначене лікування відповідно до протоколу, та ще 37 пацієнтів, які достроково вибули з-під спостереження, абсолютна різниця у частоті подій первинної кінцевої точки, що дорівнює 47 подій, на думку Ostrowska et al., навряд чи є значущою [17]. Тим більше, що за даними аналізу подій первинної кінцевої точки ефективності, що розвинулися за період від виписки зі стаціонару до моменту припинення терапії або завершення клінічного спостереження (тобто у вибірці пацієнтів, які продовжували отримувати досліджуване лікування – 1602 учасники з групи тикагрелору та 1596 учасників з групи прасугрелю), кількість подій становила 92 випадки у групі тикагрелору та 71 випадок у групі прасугрелю без статистично значущої відмінності між групами (ВР 1,34, 95% ДІ 0,98–1,82). Варто підкреслити, що міжгрупова різниця за частотою первинної кінцевої точки була отримана в основному завдяки відмінностям у частоті ІМ (тикагрелор – 96 пацієнтів, 4,8%; прасугрель – 60 пацієнтів, 3,0%, ВР 1,63, 95% ДІ 1,18–2,25), у тому числі відносно частого ІМ 4а або 4b типу (19 та 20 випадків на тлі приймання тикагрелору відповідно та 11 випадків у групі прасугрелю). На думку Ostrowska et al., ці дані знову підіймають питання про справжнє дотримання рекомендацій учасниками дослідження [17]. Згідно з результатами аналізу модифікованої вибірки ITT, частота великої кровотечі за критеріями BARC (Академічного консорціуму з вивчення кровотеч), тобто кровотеч 3–5 типів, становила 5,4% у групі тикагрелору і 4,8% у групі прасугрелю (95 vs 80 подій відповідно, ВР 1,12, 95% ДІ 0,83–1,51, р=0,46). На думку Ostrowska et al., абсолютну міжгрупову різницю в 15 геморагічних подій складно інтерпретувати, враховуючи, що з цього аналізу було виключено 233 з 2006 (12%) пацієнтів, які входили до групи прасугрелю, і лише 23 з 2012 (1%) пацієнтів, які отримували тикагрелор [17].
Результати застосування прасугрелю та тикагрелору у реальній клінічній практиці – дані з реєстру SWEDEHEART Як було сказано вище, пряме порівняння тикагрелору і прасугрелю у пацієнтів з ГКС проводилося на основі даних низки великих реєстрів, у тому числі в одному з останніх аналізів відомостей з реєстру SWEDEHEART (Swedish Web-system for enhancement and development of evidence-based care in heart disease evaluated according to recommended therapies), який був опублікований в 2021 році та охопив усіх пацієнтів з ІМ, що пройшли ЧКВ та були виписані з рекомендаціями щодо приймання прасугрелю або тикагрелору за період з 2010 по 2016 рік [18]. До результатів, що вивчалися, відносилися річна частота великих несприятливих СС і цереброваскулярних подій (МАСCЕ: смерть від будь-якої причини, ІМ або інсульт), усіх несприятливих СС і цереброваскулярних подій (NACCE: комбінація МАCСЕ і великих кровотеч) і окремих компонентів NACCE. У результаті аналізу даних 37 990 пацієнтів (2073 приймали прасугрель, 35 917 – тикагрелор) річна частота MACCE становила 6,1 vs 6,1% (скориговане ВР 1,03, 95% ДІ 0,86–1,24), а річна частота NACCE – 8,4 vs 8,7% (ВР 1,03, 95% ДІ 0,88–1,20) у групах прасугрелю і тикагрелору відповідно, тобто вплив препаратів на ризики МАССЕ та NACCE за рік спостереження був зіставним (рис.). Також за даними SWEDEHEART групи лікування не демонстрували відмінностей за рівнем загальної смертності (2,3 vs 2,9%), частотою інсульту (0,9 vs 1,1%), повторного ІМ (4,1 vs 3,2%) та великих кровотеч (2,5% vs 3,2%) [18].
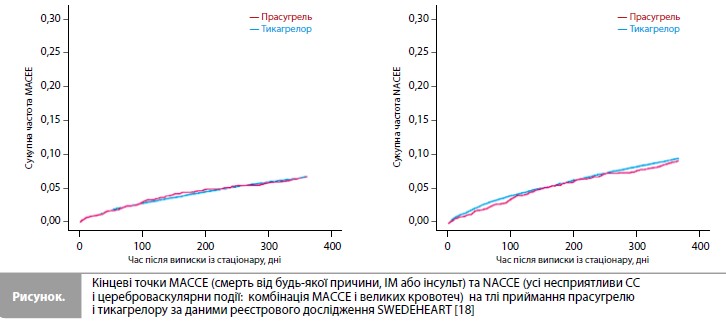
Висновок Отже, результати дослідження ISAR-REACT 5 викликають низку питань і мають інтерпретуватися з обережністю [17, 18]. Особливо незрозумілі рішення дослідників про припинення приймання досліджуваних антиагрегантів на госпітальному етапі, що призвело в результаті до порівняння груп, у яких майже третина пацієнтів не лікувалися призначеними при рандомізації препаратами. Одночасно з цим досить ризикованим є припущення про те, що більше 99% учасників самі купували і приймали призначений препарат в умовах відсутності фактичного контролю. Сумніви множаться при порівнянні результатів ISARREACT 5 з даними ранніх клінічних досліджень, що проводилися на значно більших вибірках пацієнтів. Наприклад, порівняння показників частоти первинної кінцевої точки в групах тикагрелору в дослідженнях ISAR-REACT 5 і PLATO показало зіставні значення (9,3% і 9,8% відповідно), тоді як порівняння частоти тієї ж кінцевої точки в групах прасугрелю в ISAR -REACT 5 і TRITON-TIMI 38 виявило відмінності, які важко пояснити (6,9% і 9,9% відповідно). Враховуючи суттєві обмеження дослідження ISAR-REACT 5, отримані результати вимагають вкрай обережного поводження і не можуть вважатися достатніми для зміни діючої тактики лікування. Питання щодо методики та результатів дослідження ISAR-REACT 5 додатково підтримуються даними з реальної клінічної практики (наприклад, з великого реєстру SWEDEHEART), що демонструють еквівалентність прасугрелю і тикагрелору за показниками ефективності та безпеки терапії упродовж року спостереження за пацієнтами після ГКС.
Перелік літератури знаходиться в редакції
Автор огляду Микола Горін |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2024. Усі права захищені.
|
мапа сайту корисні посилання |