Результати призначення емпагліфлозину госпіталізованим пацієнтам з гострою серцевою недостатністю: ключова інформація з дослідження EMPULSEГостра серцева недостатність (СН) є найчастішою причиною госпіталізації людей віком понад 65 років і пов’язана зі значною захворюваністю, смертністю та низькою якістю життя [1–3]. Численні рандомізовані контрольовані дослідження, у яких оцінювали стандартну фармакотерапію у пацієнтів, госпіталізованих із приводу гострої СН, не виявили покращення результатів після виписки зі стаціонару, що вказує на гостру нереалізовану потребу в нових методах лікування [4–8]. Порівняно новий клас препаратів – інгібітори натрійзалежного котранспортера глюкози (НЗКТГ) 2 типу – продемонстрував здатність до значного зниження ризику серцево-судинної (СС) смерті або госпіталізації з приводу СН у пацієнтів із хронічною СН (емпагліфлозин та дапагліфлозин) [9], а один з них – комбінований інгібітор НЗКТГ 1 та 2 типів сотагліфлозин – забезпечив покращення клінічних результатів у пацієнтів з цукровим діабетом (ЦД) та нещодавньою декомпенсацією СН [10]. Тим не менш тривалий час було невідомо, чи забезпечує емпагліфлозин клінічну користь пацієнтам, госпіталізованим із приводу гострої серцевої недостатності, наскільки безпечно розпочинати раннє лікування інгібітором НЗКТГ 2 типу (іНЗКТГ2) таким пацієнтам та чи можна призначати іНЗКТГ2 під час госпіталізації з приводу першого епізоду гострої СН пацієнтам, які ще не отримували фонову терапію СН. Для пошуку відповіді на ці запитання стосовно іНЗКТГ2 емпагліфлозину було проведено клінічне дослідження EMPULSE (Once Daily Oral EMPagliflozin 10 mg Compared to Placebo, Initiated in Patients Hospitalised for acUte Heart faiLure [de Novo or Decompensated Chronic HF] Who Have Been StabilisEd), у якому оцінювали досягнення трьох основних цілей лікування пацієнтів, госпіталізованих із приводу гострої СН: поліпшення виживаності, зниження частоти декомпенсації СН та покращення симптомів СН [11].
Основні характеристики дослідження EMPULSE Дослідження EMPULSE являло собою багатоцентрове рандомізоване подвійне сліпе плацебо-контрольоване 90-денне дослідження фази 3 і було спрямоване на оцінку ефективності, безпеки та переносимості лікування з метою підтвердження переваги терапії емпагліфлозином 10 мг 1 раз на добу, розпочатої під час госпіталізації з приводу гострої СН (першого епізоду СН [de novo] або декомпенсації хронічної СН), над плацебо. У дослідження зараховували чоловіків та жінок віком 18 років і старших, госпіталізованих унаслідок СН з будь-яким значенням фракції викиду (ФВ) лівого шлуночка (ЛШ), із симптомами СН під час надходження до стаціонару. Рандомізація для отримання емпагліфлозину або плацебо проводилася не раніше ніж через 24 год і не пізніше ніж через 5 діб після госпіталізації, тобто у найкоротший термін після стабілізації стану пацієнта, але до виписки його зі стаціонару. Під стабілізацією розуміли рівень систолічного артеріального тиску (АТ) ≥100 мм рт.ст. без симптомів гіпотензії за останні 6 год, відсутність потреби у підвищенні дози внутрішньовенного (в/в) діуретика протягом 6 год до рандомізації, відсутність терапії в/в вазодилататорами (зокрема нітратами) протягом 6 год до рандомізації й терапії в/в інотропними препаратами – протягом 24 год до рандомізації. Ще однією вимогою був підвищений рівень мозкового натрійуретичного пептиду (BNP) або N-термінального фрагмента попередника BNP (NT-proBNP) під час поточної госпіталізації або за 72 год до госпіталізації (≥400 пг/мл або ≥1600 пг/мл відповідно для пацієнтів без фібриляції передсердь [ФП] чи ≥600 пг/мл або ≥2400 пг/мл відповідно для пацієнтів із ФП). До участі в дослідженні не допускалися пацієнти з кардіогенним шоком, гострою СН, що стала наслідком емболії легеневої артерії, гострого порушенням мозкового кровообігу (ГПМК) або гострого інфаркту міокарда (ІМ), особи, які перенесли великі хірургічні втручання протягом 30 днів до рандомізації або гострий коронарний синдром/ ІМ чи ГПМК протягом 90 днів до рандомізації, реципієнти трансплантації серця, а також хворі з тяжкою гемодинамічно значущою нескоректованою клапанною хворобою серця, ЦД 1 типу або швидкістю клубочкової фільтрації (ШКФ) <20 мл/хв/1,73 м2 [11]. У дослідженні використовувалася комбінована первинна кінцева точка, що включала загальну смертність, кількість випадків декомпенсації СН (зокрема госпіталізаціі по причині СН, візити у відділення швидкої допомоги внаслідок СН та позапланові амбулаторні візити), час до розвитку першого епізоду декомпенсації СН та покращення загальної оцінки симптомів за Канзаським опитувальником для хворих з кардіоміопатією (KCCQ-TSS) щонайменше на 5 балів від вихідного рівня до 90-го дня участі в дослідженні. Як кількісну характеристику первинної кінцевої точки використовували стратифікований показник win ratio (WR, відношення кількості пацієнтів, які мали виграш від лікування, до кількості пацієнтів, що «програли », при порівнянні пар пацієнтів із зіставними ризиками подій). Такий підхід до оцінки первинної кінцевої точки був виправданий можливістю ієрархічної оцінки впливу терапії на три фундаментальні цілі лікування: поліпшення виживаності, зниження ризику декомпенсації СН та полегшення симптомів СН [11]. Компоненти первинної кінцевої точки оцінювалися не тільки в її складі, а й окремо; також була запланована оцінка кількох вторинних кінцевих точок ефективності, зокрема комбінації СС смерті та декомпенсації СН до візиту закінчення дослідження, частки пацієнтів з покращенням оцінки KCCQ-TSS як мінімум на 10 балів на 90-й день дослідження відносно вихідного рівня, абсолютна зміна оцінки KCCQ-TSS на 90-й день дослідження відносно вихідного рівня, відповідь на сечогінну терапію (зниження маси тіла в кілограмах з розрахунку на середню добову дозу діуретика), зміна концентрації NT-proBNP та інші показники [11].
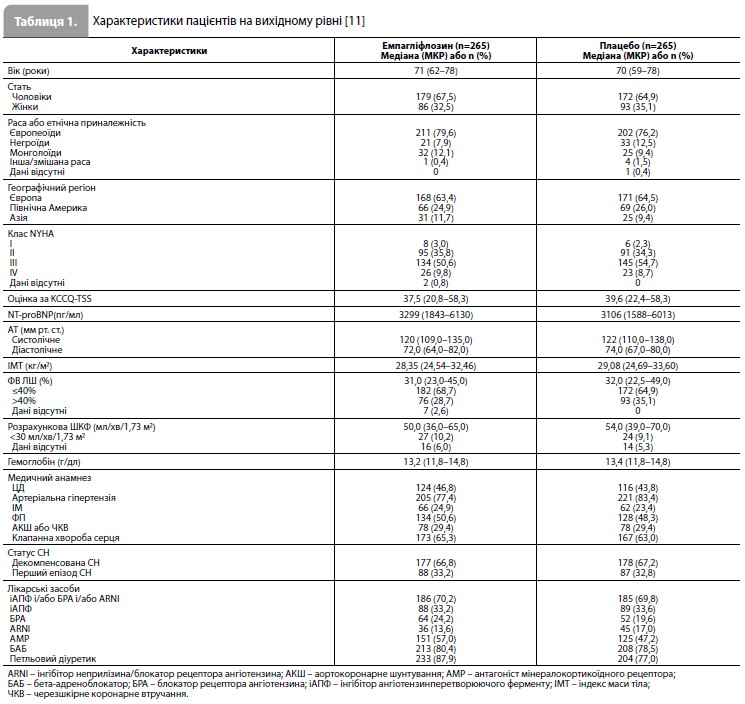
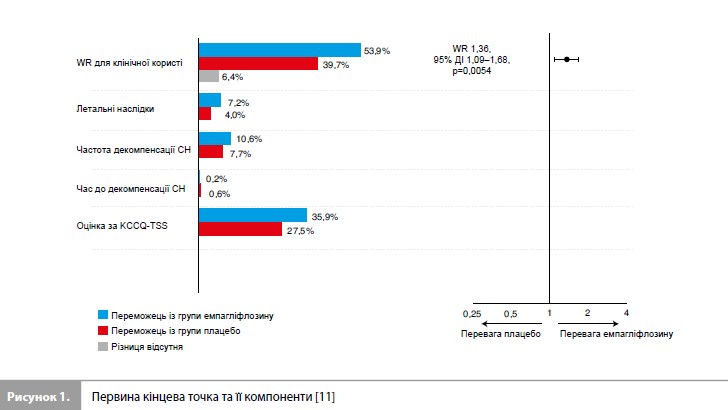
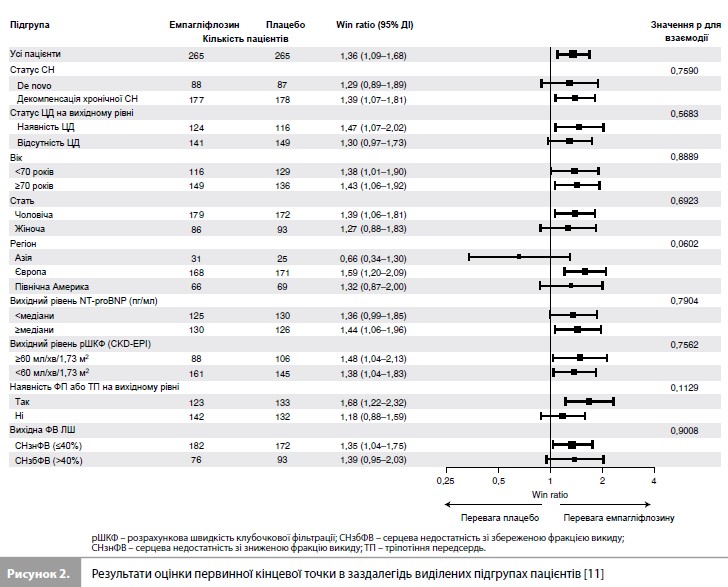
Результати дослідження EMPULSE За період з червня 2020 р. до лютого 2021 р. у дослідженні було рандомізовано 530 пацієнтів (265 – у групу емпагліфлозину та 265 – у групу плацебо) із 118 дослідницьких центрів у 15 країнах світу (табл. 1) [11]. Медіана віку становила 71 рік (міжквартильний розмах [МКР] 61–78 років), 34% учасників були жінками, 78% – представниками європеоїдної раси. Середній час від госпіталізації до рандомізації становив 3 дні (МКР 2–4 дні). Групи емпагліфлозину та плацебо були добре збалансовані за основними вихідними характеристиками (табл. 1) [11]. До аналізу ефективності були включені дані всіх 530 пацієнтів, до аналізу безпеки – дані 524 пацієнтів, які отримали як мінімум одну дозу досліджуваного препарату. Частота дострокового скасування досліджуваного препарату становила 20,0% у групі емпагліфлозину та 23,5% у групі плацебо. З-під спостереження вибули 2,1% пацієнтів [11]. Результати оцінки первинної комбінованої кінцевої точки дослідження стисло представлені на рисунку 1 та в таблиці 2 [11]. Протягом дослідження померли загалом 11 пацієнтів (4,2%) у групі емпагліфлозину та 22 (8,3%) – у групі плацебо. Як мінімум один епізод декомпенсації СН був зареєстрований у 10,6% пацієнтів у групі емпагліфлозину та у 14,7% пацієнтів у групі плацебо. Скоригована середня зміна оцінки KCCQ-TSS від вихідного рівня до 90-го дня становила 36,2 бала (95% довірчий інтервал [ДІ] 33,3–39,1) у групі емпагліфлозину та 31,7 бала (95% ДІ 28, 8–34,7) у групі плацебо. При попарних порівняннях, що проводилися для оцінки первинної комбінованої кінцевої точки, емпагліфлозин мав перевагу у 53,9% порівнянь, плацебо – у 39,7% порівнянь, результати у 6,4% попарних порівнянь не виявили різниці між досліджуваними препаратами, що дає значення WR 1,36 на користь емпагліфлозину (95% ДІ 1,09–1,68, p=0,0054) (табл. 2) [11]. Аналіз у підгрупах (рис. 2), виділених з урахуванням типу гострої СН (de novo vs декомпенсація хронічної СН), наявності ЦД, віку, статі, географічного регіону, вихідного рівня NT-proBNP, функції нирок, наявності ФП та величини ФВ ЛШ, продемонстрував стабільність ефекту емпагліфлозину у всіх заздалегідь виділених підгрупах пацієнтів [11].
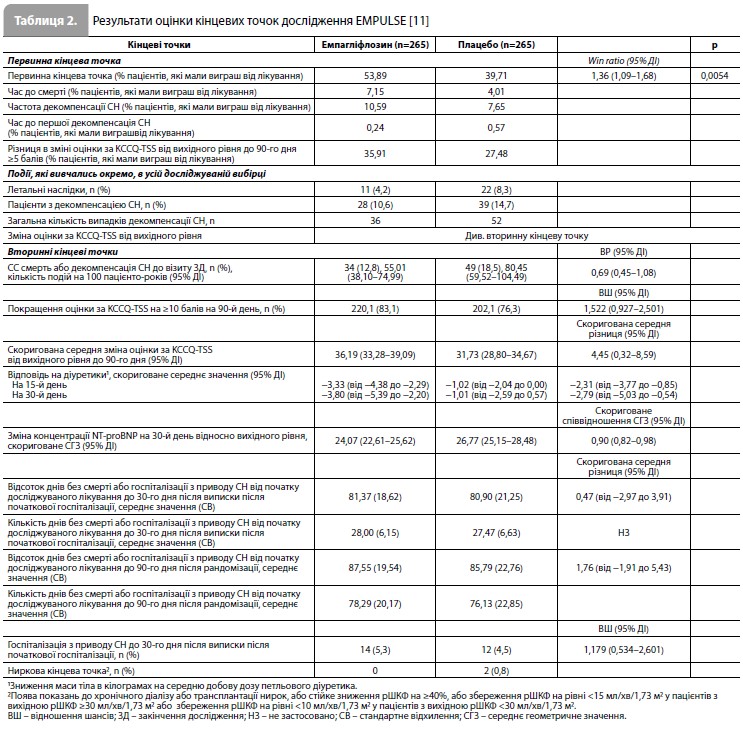
Оцінка вторинних кінцевих точок показала такі результати. Частота подій у вигляді СС смерті або декомпенсації СН до візиту закінчення дослідження становила 12,8% у групі емпагліфлозину та 18,5% у групі плацебо (відношення ризиків [ВР] 0,69, 95% ДІ 0,45–1,08). Міжгрупова різниця по частці пацієнтів з поліпшенням оцінки KCCQ-TSS як мінімум на 10 балів на 90-й день дослідження була несуттєвою, проте абсолютна зміна оцінки KCCQ-TSS від вихідного рівня до 90-го дня була вищою у пацієнтів у групі емпагліфлозину порівняно з хворими із групи плацебо (скоригована середня різниця 4,45 бала; 95% ДІ 0,32–8,59). Зниження концентрації NT-proBNP на 30-й день порівняно з вихідним рівнем також було більш вираженим у пацієнтів у групі емпагліфлозину порівняно з групою плацебо (скориговане співвідношення середніх геометричних значень 0,90; 95% ДІ 0,82–0,98). Інші вторинні кінцеві точки наведено в таблиці 2 [11]. Аналіз даних щодо безпеки показав, що частота небажаних явищ, які призвели до скасування емпагліфлозину або плацебо, становила 8,5% і 12,9% відповідно. У жодній із груп лікування не зареєстровано розвитку кетоацидозу. Частота гіповолемії, серйозної симптоматичної гіпотензії, гіпоглікемії, гострої ниркової недостатності та інфекції сечовивідних шляхів становила 12,7 vs 10,2%, 1,2 vs 1,5%, 1,9 vs 1,5%, 7,7 vs 12, 1% та 4,2 vs 6,4% у групах емпагліфлозину та плацебо відповідно. Результати оцінки скоригованих середніх змін рівнів гематокриту, гемоглобіну, аланінамінотрансферази, аспартатамінотрансферази, сечової кислоти та розрахункової ШКФ за період від початкового рівня до 90-го дня участі у дослідженні не вказують на наявність проблем з безпекою емпагліфлозину [11]. Більше того, у групі емпагліфлозину спостерігалося більш виражене збільшення рівнів гематокриту та гемоглобіну порівняно з групою плацебо. Моніторинг АТ, у свою чергу, показав, що скоригована середня зміна показника від вихідного рівня до 90-го дня участі в дослідженні становила: для систолічного АТ – 0,1 мм рт.ст. (95% ДІ від -2,5 до 2,7) у групі емпагліфлозину та 1,0 мм рт.ст. (95% ДІ від -1,6 до 3,6) у групі плацебо; для діастолічного АТ – -0,3 мм рт.ст. (95% ДІ від -1,8 до 1,3) у групі емпагліфлозину та -0,7 мм рт.ст. (95% ДІ від -2,3 до 0,8) у групі плацебо [11].

Висновки Отже, результати дослідження EМPULSE показали, що початок застосування іНЗКТГ2 емпагліфлозину на етапі стаціонарного лікування у пацієнтів, госпіталізованих з приводу гострої СН, забезпечував статистично та клінічно значущу користь упродовж 90 днів після рандомізації, що підтверджується зниженням ризику смерті від усіх причин і декомпенсації СН, а також поліпшенням якості життя пацієнтів у групі емпагліфлозину. Ефект емпагліфлозину проявлявся однаково в різних підгрупах пацієнтів, зокрема у хворих зі зниженою та збереженою ФВ ЛШ, з першим епізодом гострої СН та з декомпенсованою хронічною СН, а також у пацієнтів з ЦД та без ЦД. Учасники дослідження EMPULSE добре переносили емпагліфлозин без розвитку явних проблем із безпекою, у тому числі без підвищення ризику погіршення функції нирок, розвитку кетоацидозу або гіповолемії. Важливо, що ефекти лікування емпагліфлозином, зафіксовані в дослідженні EMPULSE, спостерігалися протягом періоду, який починався з 3-го (у середньому) і закінчувався 90-м днем після госпіталізації з приводу СН, тобто протягом етапу найбільшої вразливості пацієнтів з гострою СН. У цілому, результати дослідження EMPULSE показують, що початок застосування емпагліфлозину в рамках стандартної терапії у пацієнтів, госпіталізованих з приводу гострої СН, пов’язаний з клінічно значущим поліпшенням стану за даними через 90 днів без розвитку проблем з безпекою лікування.
Список літератури знаходиться в редакції
Автор огляду Олена Грибова Medicine Review 2022; 2 (65): 25 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2024. Усі права захищені.
|
мапа сайту корисні посилання |