Роль безаспіринових антиагрегантних стратегій у веденні пацієнтів після ЧКВ: огляд доказової базиУ наш час у пацієнтів після черезшкірних коронарних втручань (ЧКВ) подвійна антитромбоцитарна терапія (ПАТ) ацетилсаліциловою кислотою (АСК) та інгібітором P2Y12-рецептора тромбоцитів (іP2Y12) є рекомендованою антиагрегантною терапією вибору [1, 2]. Ця рекомендація ґрунтується на результатах плацебо-контрольованих досліджень, які продемонстрували користь додавання іP2Y12 клопідогрелю до АСК [3]) і пізніше – вищу клінічну ефективність ПАТ на основі потужніших іP2Y12 прасугрелю і тикагрелору порівняно з ПАТ на основі клопідогрелю у хворих після ЧКВ [4, 5]. Слід зазначити, що в цих дослідженнях оцінювали різну тривалість ПАТ, після якої хворі переводилися на довічну монотерапію АСК [1, 2]. Користь від ПАТ після ЧКВ проявляється в зниженні ризику ішемічних подій, яке, однак, супроводжується зростанням ризику кровотеч, що обґрунтовує пошук антиагрегантних стратегій, які б знижували геморагічний ризик порівняно зі стандартною схемою «12-місячна ПАТ + подальша довічна монотерапія АСК». Одна з таких стратегій зі зменшення ризику кровотеч без втрати антитромботичного ефекту передбачає вкорочення ПАТ із подальшим переведенням пацієнта на монотерапію іP2Y12 [6] і ґрунтується на припущенні, що ефективність монотерапії іP2Y12 може бути зіставною з ефективністю ПАТ, оскільки АСК суттєво не знижує реактивність тромбоцитів при додаванні до потужніших іP2Y12 [7–9]. Цю гіпотезу активно вивчають у рандомізованих клінічних дослідженнях (РКД), у тому числі в РКД, які порівнюють ефекти стандартної ПАТ із монотерапією іP2Y12, розпочатою одразу після ЧКВ або після дуже короткого курсу ПАТ, у пацієнтів, які пройшли ЧКВ (рис. 1) [10]. Крім того, враховуючи, що уявлення про роль монотерапії АСК у довгостроковій вторинній профілактиці серцево-судинних (СС) ускладнень базується на старих дослідженнях, котрі проводили до появи більш ефективних сучасних антитромбоцитарних стратегій, виникла потреба в переоцінці відносного ефекту АСК порівняно з іP2Y12 під час застосування в якості хронічної антитромбоцитарної монотерапії після перенесеного ЧКВ. Capranzano et al. проаналізували результати цих досліджень, їхню практичну значущість, а також поточні проблеми й можливі перспективи існуючих безаспіринових стратегій і представили результати свого аналізу у вигляді огляду [10], основні положення якого коротко викладено нижче.
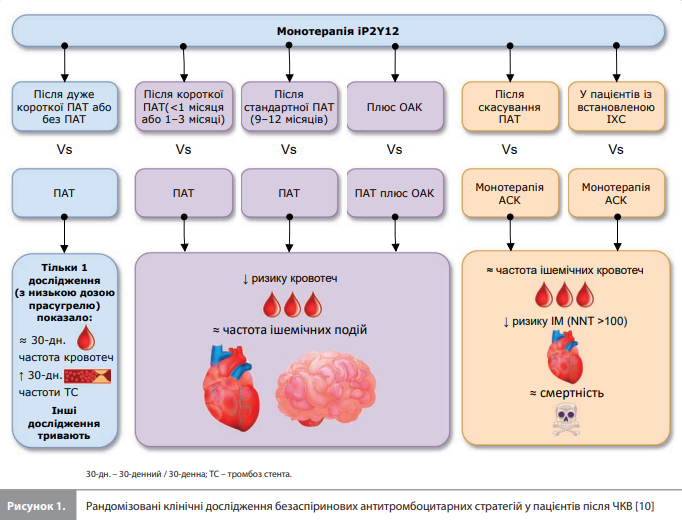
Монотерапія іP2Y12 vs стандартна ПАТ У цю групу входять дослідження, що порівнювали стандартну ПАТ із монотерапією іP2Y12 (тикагрелором або клопідогрелем), розпочату після короткої (1–3 місяці після ЧКВ), дуже короткої (<1 місяця після ЧКВ) ПАТ або без попередньої ПАТ (монотерапію іP2Y12 розпочинали під час ЧКВ), а також одне дослідження, у якому порівнювали подовжену ПАТ і монотерапію клопідогрелем після стандартної (9–12 місяців) ПАТ у хронічній фазі коронарного синдрому після ЧКВ у пацієнтів із групи високого ризику, у яких може бути корисним подовження ПАТ. Монотерапія тикагрелором після ПАТ (дослідження GLOBAL LEADERS, GLASSY, TWILIGHT, TICO і T-PASS: монотерапія тикагрелором після короткої ПАТ vs 12-місячна ПАТ). У відкритому дослідженні GLOBAL LEADERS (n=15 968) результати 23-місячної монотерапії тикагрелором після 1-місячної ПАТ порівнювали з результатами 12-місячної ПАТ (АСК + клопідогрель у пацієнтів із хронічним коронарним синдромом [ХКС] або АСК + тикагрелор у пацієнтів із гострим коронарним синдромом [ГКС]), після якої слідували 12 місяців монотерапії АСК [11]. За дворічний період спостереження не було виявлено суттєвих міжгрупових відмінностей за частотою первинної кінцевої точки – комбінації смерті від будь-яких причин і несмертельного Q-інфаркту міокарда (ІМ), а також за частотою великих або малих кровотеч. Так само в дослідженні GLASSY (n=7585, додаткове дослідження до GLOBAL LEADERS), яке включило пацієнтів із 20 дослідницьких центрів із найбільшим набором учасників GLOBAL LEADERS, монотерапія тикагрелором не поступалася стандартній ПАТ, хоча й не перевершувала її ані за 2-річною частотою кінцевої точки, що включала комбінацію смерті від усіх причин, несмертельного ІМ, несмертельного інсульту або термінової реваскуляризації цільової судини, ані за частотою кровотеч [12]. Ці результати свідчать про відсутність істотної користі, але також і про відсутність шкоди від раннього переходу на монотерапію тикагрелором порівняно зі схемою, яка включає 12-місячну ПАТ із подальшою монотерапією АСК, у гетерогенній вибірці пацієнтів після ЧКВ.

У подвійному сліпому дослідженні TWILIGHT тестували гіпотезу про перевагу монотерапії тикагрелором над стандартною ПАТ із погляду впливу на ризик великої або клінічно значущої малої кровотечі в пацієнтів після ЧКВ (n=7119), які не мали ішемічних чи геморагічних подій на тлі первинної 3-місячної ПАТ та мали високий ризик кровотечі або ішемічної події [13]. Через рік після рандомізації монотерапія тикагрелором забезпечила значне відносне зниження частоти первинної геморагічної кінцевої точки й частоти великих кровотеч на 44% і 51% відповідно, не поступаючись ПАТ за впливом на ризик основної ішемічної кінцевої точки (комбінація смерті від усіх причин, несмертельного ІМ і несмертельного інсульту). Дослідження TICO за участю 3056 пацієнтів із ГКС, які пройшли ЧКВ у Південній Кореї, виявило, що загальне число несприятливихі клінічних (ішемічних і геморагічних) подій (net clinical outcome) за рік спостереження значно знизилося при використанні 3-місячної ПАТ із подальшим переходом на монотерапію тикагрелором порівняно з 12-місячною ПАТ, що було зумовлено нижчим ризиком великих кровотеч у групі монотерапії (1,7 vs 3,0%, відношення ризиків [ВР] 0,56, 95% довірчий інтервал [ДІ] 0,34–0,91, р=0,02) за відсутності істотних відмінностей за частотою ішемічних подій [14]. У відкритому дослідженні T-PASS спостерігалися схожі результати, які показали, що серед пацієнтів із ГКС (n=2850) із Південної Кореї монотерапія тикагрелором, розпочата після скасування АСК упродовж 1 місяця (у середньому через 16 днів) після ЧКВ, перевершувала стандартну 12-місячну ПАТ за впливом на первинну кінцеву точку – загальну кількість несприятливих клінічних (ішемічних і геморагічних) подій за рік спостереження, що було зумовлено значним зниженням частоти великих кровотеч (1,2 vs 3,4%, ВР 0,35, 95% ДІ 0,20–0,61, p<0,001) [15]. Отже, представлені дослідження засвідчили, що використання монотерапії тикагрелором після короткого (зокрема тривалістю менше ніж 1 місяць) курсу ПАТ дає результати, які є аналогічними або перевершують результати стандартної ПАТ. Монотерапія клопідогрелем після ПАТ (дослідження SMART-CHOICE, STOPDAPT-2, STOPDAPT-2 ACS: коротка ПАТ із подальшою монотерапією іP2Y12 [переважно клопідогрелем] vs 12-місячна ПАТ у пацієнтів зі Східної Азії, які перенесли ЧКВ). У відкритому дослідженні SMARTCHOICE (n=2993) схема, що включала 3-місячну ПАТ із подальшою монотерапією клопідогрелем, не поступалася 12-місячній ПАТ за впливом на річну частоту подій первинної комбінованої ішемічної кінцевої точки й значно знижувала ризик кровотеч [16]. Відносно широкий ДІ для не меншої ефективності обмежував статистичну потужність дослідження для оцінки ішемічних подій. Відкрите дослідження STOPDAPT-2 показало, що серед 3045 японських пацієнтів, які перенесли ЧКВ під контролем внутрішньокоронарної візуалізації, монотерапія клопідогрелем, розпочата через місяць після ЧКВ, перевершувала 12-місячну ПАТ за впливом на загальну кількість несприятливих клінічних (ішемічних та геморагічних) подій за рік спостереження, що було зумовлене зниженням загальної кількості кровотеч без істотних відмінностей за частотою ішемічних подій [17]. Однак на значущість цих результатів може вплинути нижча, ніж очікувалося, частота подій первинної кінцевої точки, дуже низька статистична потужність дослідження для оцінки ішемічних подій, набір пацієнтів із групи низького ризику й обмежене застосування внутрішньосудинної візуалізації в реальній клінічній практиці. У РКД STOPDAPT-2 ACS були включені учасники з ГКС із дослідження STOPDAPT-2, а також знову рандомізовані пацієнти, що збільшило досліджувану вибірку пацієнтів із ГКС до 4136 осіб [18]. Через рік спостереження не вдалося довести, що монотерапія клопідогрелем після 1- або 2-місячної ПАТ не поступається 12-місячній ПАТ за впливом на загальну кількість несприятливих клінічних (ішемічних і геморагічних) подій через чисельне збільшення частоти ІМ у групі монотерапії, що підкреслює важливість правильного вибору іP2Y12 для монотерапії після короткої ПАТ у пацієнтів із ГКС. Водночас нижча, ніж очікувалося, частота подій первинної кінцевої точки робить статистичну потужність дослідження недостатньо великою, а його результати – недостатньо переконливими. Цікаві результати порівняння монотерапії клопідогрелем із ПАТ були отримані під час хронічної фази коронарного синдрому після ЧКВ у дослідженні OPT-BIRISK (монотерапію іP2Y12 розпочинали після 9–12-місячної первинної ПАТ і порівнювали з подовженою ПАТ) [19]. У цьому дослідженні монотерапія клопідогрелем перевершувала подовжену ПАТ як за впливом на первинну кінцеву точку – кровотечі 2, 3 або 5 типу за класифікацією Академічного консорціуму з вивчення кровотеч (BARC) за 9 місяців спостереження (2,5 vs 3,3%, ВР 0,75, 95% ДІ 0,57–0,97, р=0,03), так і за впливом на частоту ішемічних подій [Yaling Han, неопубліковані дані]. Нарешті, використання безаспіринового підходу з переважним застосуванням клопідогрелю вивчали в кількох дослідженнях у пацієнтів після ЧКВ із супутнім показанням до призначення пероральних антикоагулянтів (ОАК), що продемонстрували більшу безпечність і зіставну ефективність подвійної (іP2Y12 плюс ОАК) порівняно з потрійною (ПАТ плюс ОАК) антитромботичною терапією [20]. Монотерапія іP2Y12 без початкової ПАТ або після дуже короткої ПАТ. Гіпотезу про те, що монотерапія потужним іP2Y12, розпочата одразу після ЧКВ, може зменшити ризик кровотеч без втрати протиішемічної ефективності порівняно зі стандартною ПАТ, перевіряли в дослідженні STOPDAPT-3 (6002 японських пацієнти з ГКС або високим ризиком кровотечі [ВРК]). У цій ситуації безаспіриновий підхід із прийманням низької дози прасугрелю (навантажувальна доза 20 мг, підтримувальна – 3,75 мг), розпочатим під час ЧКВ, не привів до зниження 30-денного ризику великих кровотеч і збільшив 30-денний ризик тромбозу стента й незапланованої коронарної реваскуляризації порівняно зі стандартною ПАТ. Ці результати обмежують значущість позитивних попередніх висновків на основі результатів пілотних досліджень, які засвідчили відсутність явних проблем із безпекою монотерапії тикагрелором або прасугрелем, розпочатої одразу після ЧКВ у пацієнтів із групи низького ризику [10].
Монотерапія іP2Y12 vs ПАТ у підгрупах високого ризику ГКС. На результати деяких досліджень монотерапії іP2Y12 могло вплинути одночасне включення пацієнтів із ГКС і ХКС, оскільки ці групи пацієнтів мають різні ризики ішемічних подій і кровотеч. Із наведених вище досліджень тільки в TICO, T-PASS і STOPDAPT-2 ACS набирали виключно пацієнтів із ГКС [14, 15, 18]. Із цих досліджень у STOPTDAP-2 ACS монотерапія клопідогрелем продемонструвала тенденцію до збільшення ішемічного ризику порівняно з ПАТ, а в дослідженні TICO антиішемічна ефективність монотерапії тикагрелором не відрізнялася від такої в ПАТ як у загальній вибірці хворих на ГКС, так і в підгрупах високого ризику (наприклад, у пацієнтів із цукровим діабетом або ІМ із підйомом сегмента ST [ІМпЅТ]) [21, 22]. Слід зазначити, що, хоча виняткова участь пацієнтів зі Східної Азії, оцінка кінцевої точки у вигляді загальної кількості несприятливих ішемічних (ішемічних і геморагічних) клінічних подій і нижча, ніж очікувалося, частота подій можуть обмежувати узагальнюваність і внутрішню достовірність результатів досліджень TICO і T-PASS, спостережуваний у них сприятливий профіль ефектів монотерапії тикагрелором у пацієнтів із ГКС також підтвердився в аналізах підгруп, проведених на основі даних із досліджень GLOBAL LEADERS і TWILIGHT [23, 24]. Так, на відміну від результатів основного дослідження GLOBAL LEADERS, етапний аналіз даних, зібраних за період із 31-го до 365-го дня після рандомізації серед пацієнтів із ГКС (n=7487, 28% з ІМпST), показав, що монотерапія тикагрелором значно знижує відносний ризик великої кровотечі на 48% порівняно з ПАТ на основі тикагрелору й чисельно знижує частоту смерті або Q-ІМ [23]. Крім того, монотерапія тикагрелором порівняно з ПАТ значно знижувала дворічний ризик великої кровотечі серед пацієнтів із ГКС, але не серед пацієнтів із ХКС [24]. Водночас, аналіз у підгрупах дослідження TWILIGHT показав, що порівняно з ПАТ монотерапія тикагрелором значно знижує ризик кровотеч (на 53%) серед пацієнтів із ГКС без підйому сегмента ST і на 24% – серед пацієнтів без ГКС [25]. Показники частоти подій кінцевих точок ефективності в групах лікування були зіставними незалежно від клінічної картини (пацієнти з ГКС без підйому ST vs пацієнти без ГКС). Ці результати дають змогу припустити, що клінічні переваги переходу на монотерапію тикагрелором після короткої ПАТ зберігаються і навіть відносно посилюються в пацієнтів із ГКС, імовірно, через характерний для них вищий ризик кровотеч порівняно з пацієнтами з ХКС. Однак для підтвердження результатів, отриманих в аналізах підгруп пацієнтів, необхідні подальші спеціалізовані дослідження на вибірках пацієнтів із ГКС, у тому числі пацієнтів із групи підвищеного ризику [10]. Складне ЧКВ. Проведені аналізи в підгрупах і метааналізи виявили зниження ризику кровотеч без збільшення частоти ішемічних подій при застосуванні схеми із використанням 1–3-місячної ПАТ із подальшою монотерапією іP2Y12 порівняно з 12-місячною ПАТ серед пацієнтів, які пройшли складне ЧКВ [26–31]. У метааналізі досліджень GLASSY, SMARTCHOICE, STOPDAPT-2, TICO і TWILIGHT (n=22 941, із них 20,4% – пацієнти зі складним ЧКВ) [30] показники частоти первинної кінцевої точки, що включала смерть від усіх причин, ІМ та інсульт, були зіставними в групах монотерапії іP2Y12 і ПАТ як серед пацієнтів зі складним ЧКВ (3,61 vs 4,10%, ВР 0,87, 95% ДІ 0,64–1,19), так і серед пацієнтів із нескладним ЧКВ (2,75 vs 3,21%, ВР 0,91, 95% ДІ 0,76–1,09), при цьому монотерапія іP2Y12 знижувала частоту великих кровотеч незалежно від складності ЧКВ. Однак ці позитивні результати слід інтерпретувати з урахуванням специфічних характеристик підгрупи пацієнтів зі складним ЧКВ, у тому числі високої частки пацієнтів зі Східної Азії (~37%) і учасників із ХКС (39%), а також лише невеликої кількості хворих на ІМпST (n=553). Отже, для підтвердження отриманих результатів необхідні дослідження монотерапії іP2Y12, що включають пацієнтів після більш складних процедур ЧКВ [10]. Високий ризик кровотечі. Результати апостеріорного аналізу даних із РКД, що порівнювали монотерапію іP2Y12 після короткої ПАТ зі стандартною ПАТ із врахуванням ризику кровотеч, показали, що зниження ризику кровотеч без збільшення частоти комбінованої ішемічної кінцевої точки спостерігалося незалежно від вихідного геморагічного ризику, однак величина ефекту була більшою серед пацієнтів із ВРК. Крім того, нещодавній метааналіз об'єднаних даних пацієнтів із ВРК із досліджень, що порівнювали монотерапію іP2Y12 зі стандартною ПАТ, і досліджень, що порівнювали результати короткої (≤3 місяців) і стандартної (≥6 місяців) ПАТ (у яких після завершення короткої ПАТ пацієнти отримували монотерапію АСК), показав, що серед 9006 учасників 11 досліджень із ВРК після ЧКВ коротка ПАТ асоціювалася зі значним зниженням великих або клінічно значущих малих кровотеч і СС смертності без зниження ефективності протиішемічного захисту [32].
Метааналізи досліджень, що порівнювали монотерапію іP2Y12 зі стандартною ПАТ Метааналізи результатів досліджень GLOBAL LEADERS, SMART-CHOICE, STOPDAPT-2, TWILIGHT і TICO підтвердили, що скасування АСК через 1–3 місяці ПАТ після ЧКВ пов'язане зі значним зниженням ризику кровотеч без збільшення частоти окремих ішемічних подій, незалежно від клінічного варіанту коронарного синдрому [33, 34]. Аналіз Sidney-2 Collaboration, що включив дані 24 096 учасників шести РКД (GLASSY, SMART-CHOICE, STOPDAPT-2, TWILIGHT і TICO плюс дослідження DACAB, яке оцінювало прохідність аортокоронарного шунта під час застосування тикагрелору в комбінації з АСК або без неї порівняно з монотерапією АСК), показав, що монотерапія іP2Y12 не поступалася ПАТ за впливом на комбінацію смерті, інсульту або ІМ (ВР 0,93, 95% ДІ 0,79–1,09, р=0,005) і при цьому значно знижувала ризик кровотеч. Аналогічні результати спостерігалися в підгрупі пацієнтів із ГКС [35]. Інший метааналіз даних, що включив результати досліджень GLASSY і TWILIGHT (n=14 628), показав зниження ризику великих кровотеч і смерті на тлі монотерапії тикагрелором порівняно з ПАТ без істотних міжгрупових відмінностей за загальною частотою ішемічних подій [36]. Результати цих метааналізів (жоден із них не включав дані дослідження STOPDAPT-2 ACS) додатково підтверджують позитивний ефект стратегії переходу на монотерапію іP2Y12 після короткої ПАТ у пацієнтів після ЧКВ, продемонстрований в окремих дослідженнях.
Механізм реалізації клінічних переваг монотерапії іP2Y12 порівняно з ПАТ Для вивчення механізмів, які могли б привести до відмінностей, що спостерігалися при порівнянні монотерапії іP2Y12 зі стандартною ПАТ у РКД, було проведено низку фармакодинамічних піддосліджень, які розширили розуміння отриманих клінічних результатів [37–39]. Так, у піддослідженні функції тромбоцитів у рамках РКД TWILIGHT [37] показники реактивності тромбоцитів на тлі монотерапії тикагрелором були зіставними з такими на тлі ПАТ у реакціях зі стимуляцією агрегації аденозиндифосфатом і тромбіном і були вищими, ніж на тлі ПАТ, у реакціях з арахідоновою кислотою і колагеном (маркери блокади циклооксигенази-1), при цьому величина антитромботичного ефекту, виміряна за площею тромбоцитарного тромбу методом динамічного потоку, була однаковою за використання обох антиагрегантних стратегій, даючи змогу припустити, що монотерапія тикагрелором забезпечує достатню блокаду ключових шляхів тромбоутворення. Схожі результати спостерігалися в піддослідженні функції тромбоцитів у рамках дослідження GLOBAL LEADERS, яке показало збільшення агрегації тромбоцитів у відповідь на вплив арахідонової кислоти й колагену після скасування АСК через місяць ПАТ [38]. Нарешті, РКД TEMPLATE (n=110) показало, що через 4 тижні після ЧКВ агрегація тромбоцитів на тлі монотерапії тикагрелором була зіставною з такою на тлі ПАТ після стимуляції пептидом активації рецептора тромбіну-6 та агоністом рецептора тромбоксану А2 і вищою, ніж на тлі ПАТ у реакції зі спорідненим колагену пептидом, що стимулює рецептор глікопротеїну VI [39]. У сукупності ці результати дають змогу припустити, що порівняно з ПАТ монотерапія тикагрелором однаковою мірою пригнічує більшість шляхів активації тромбоцитів, окрім активації у відповідь на дію чутливих до ЦОГ-1 агоністів, яку монотерапія пригнічує слабкіше, ніж ПАТ, що гіпотетично може забезпечувати такий рівень реактивності, який поліпшує гемостаз без істотного впливу на процес утворення тромбів. Слід зазначити, що описані фармакодинамічні ефекти монотерапії тикагрелором можуть бути відсутні при використанні клопідогрелю через більшу варіабельність і меншу інтенсивність інгібуючих ефектів останнього [40].
Монотерапія іP2Y12 vs монотерапія АСК Дослідження. У невеликій кількості досліджень проводили пряме порівняння монотерапії іР2Y12 і монотерапії АСК після різних за тривалістю періодів ПАТ у пацієнтів після ЧКВ. Одним із таких досліджень було РКД HOST-EXAM, що безпосередньо порівнювало монотерапію АСК і клопідогрелем після 6–18-місячної ПАТ у 5438 південнокорейських пацієнтів [41]. У цьому дослідженні клопідогрель порівняно з АСК забезпечив значне 27% відносне зниження 2-річної частоти подій первинної кінцевої точки (загальна частота несприятливих клінічних ішемічних і геморагічних подій), здебільшого за рахунок зниження частоти кровотеч, інсультів і повторних госпіталізацій із приводу ГКС [42]. Тим часом можливість узагальнення цих сприятливих результатів обмежена з огляду на вищу поширеність цитохромних мутацій, що спричиняють ослаблений антиагрегантний ефект клопідогрелю, у пацієнтів зі Східної Азії [43, 44] і меншу частоту тромботичних подій у пацієнтів зі Східної Азії порівняно з пацієнтами європеоїдного походження [45]. Ще одне пряме порівняння монотерапії іP2Y12 і монотерапії АСК після ЧКВ проводили під час етапного аналізу в рамках дослідження GLOBAL LEADERS, що охопив період від 12-го до 24-го місяця після ЧКВ, коли пацієнти отримували монотерапію тикагрелором або АСК [46]. Цей аналіз показав, що серед пацієнтів (n=11 121), які пережили перший рік після ЧКВ без розвитку несприятливих подій і продовжували дотримуватися призначеної терапії, монотерапія тикагрелором асоціювалася з меншим ризиком ІМ і чисельно більшим ризиком кровотеч порівняно з АСК. Однак число пацієнтів, яких необхідно пролікувати для профілактики одного ІМ (NNT), було високим, що свідчить проти рутинного використання тикагрелору замість АСК по завершенні першого року після ЧКВ. І, нарешті, було проведено непряме порівняння двох варіантів монотерапії у двох вибірках пацієнтів, які перенесли ЧКВ із приводу ГКС і отримували монотерапію іP2Y12 після 3-місячної ПАТ і монотерапію АСК після 6-місячної ПАТ у РКД SMART-CHOICE і SMART-DATE відповідно [47]. Результати порівняння засвідчили, що монотерапія іP2Y12 супроводжувалася тенденцією до зниження ризику ІМ і кровотеч, що, однак, вимагає обережної інтерпретації через притаманні непрямим порівнянням обмеження і низьку частоту подій у дослідженнях. Метааналізи. Мережевий метааналіз порівняв результати монотерапії іP2Y12 і монотерапії АСК, які проводили після скасування ПАТ у пацієнтів після ЧКВ, об'єднавши результати прямих порівнянь із дослідження HOST-EXAM і етапного аналізу GLOBAL LEADERS із результатами непрямих порівнянь із РКД, які окремо порівнювали стандартну ПАТ із монотерапією іP2Y12 або монотерапією АСК після короткої ПАТ [48]. Серед 73 126 учасників 19 досліджень монотерапія АСК порівняно з монотерапією іP2Y12 була пов'язана зі значним 32% відносним збільшенням частоти ІМ і зіставною частотою кровотеч. Обидва варіанти монотерапії асоціювалися із зіставними ризиками смерті, інсульту й тромбозу стента. У групі монотерапії іP2Y12 показник NNT для запобігання одному ІМ становив 261 у загальному аналізі та 155 в аналізі результатів прямих порівнянь, що припускає потенційно значущішу перевагу цього варіанта монотерапії при порівнянні однорідних вибірок пацієнтів. Схожі результати були отримані в інших метааналізах, що порівнювали монотерапію іP2Y12 із монотерапією АСК в умовах вторинної СС профілактики в пацієнтів з атеросклеротичним захворюванням. Один із таких аналізів, PANTHER (n=24 325), був присвячений оцінці даних із двох досліджень з оцінки ефектів двох режимів монотерапії, призначених через 6–18 місяців після ЧКВ, у пацієнтів з ішемічною хворобою серця (ІХС) (GLASSY, HOST-EXAM), двох досліджень із початком оцінювання ефектів через 24 години після операції на серці (DACAB і TiCAB) і трьох досліджень за участю хворих зі стабільною ІХС і нещодавно перенесеним ІМ (ASCET, CADET і CAPRIE) [49]. Серед пацієнтів (n=12 178), яким було призначено монотерапію іP2Y12 (переважно клопідогрелем, 62,0%), 2-річна частота подій первинної кінцевої точки у вигляді комбінації ІМ, інсульту й смерті від СС причин була нижчою порівняно з такою в пацієнтів, що приймали АСК (n=12 147), здебільшого через зниження ризику ІМ (NNT 136), без міжгрупових відмінностей за частотою великих кровотеч. При інтерпретації цих результатів слід враховувати факт їх проведення до впровадження сучасних стратегій СС профілактики [50]. Важливим висновком за результатами цих метааналізів є в цілому зіставний ризик кровотеч при застосуванні двох режимів монотерапії (іP2Y12 та АСК). Однак досі залишається нез'ясованим питання щодо ризику шлунково-кишкових кровотеч на тлі монотерапії клопідогрелем порівняно з монотерапією АСК [10].
Вибір антиагрегантної стратегії На підставі постійно зростаючої бази даних, що підтримують використання монотерапії іP2Y12, в американських і європейських настановах 2021 і 2020 років з'явилася рекомендація, згідно з якою в окремих пацієнтів після ЧКВ слід розглядати можливість використання короткої ПАТ із подальшим переходом на монотерапію іP2Y12 [1, 51]. Після публікації цих настанов у консенсусному документі було запропоновано використовувати схему, що включає 1–3-місячну ПАТ із подальшим переходом на монотерапію іP2Y12, як стратегію за замовчуванням, а стандартну / пролонговану ПАТ – лише в пацієнтів із високим ішемічним ризиком і дуже низьким ризиком кровотечі [52, 53]. Проте, у пізніших редакціях американських і європейських настанов від 2023 р. 6- і 12-місячну ПАТ, як і раніше, представлено як стратегії, використовувані за замовчуванням у пацієнтів, які перенесли ЧКВ із приводу стабільної ІХС або ГКС відповідно, тоді як можливість переходу на монотерапію іP2Y12 після короткої ПАТ пропонується розглядати в окремих пацієнтів для зниження геморагічного ризику [54, 55]. Згідно з європейськими рекомендаціями щодо ведення ГКС від 2023 р., монотерапію (переважно іP2Y12) слід розглядати після короткої ПАТ (3–6 місяців, без ішемічних явищ) у пацієнтів без високого ішемічного ризику. Крім того, на думку авторів цього документа, також можна розглядати можливість застосування 1-місячної ПАТ із подальшим переходом на монотерапію АСК або іP2Y12 у пацієнтів із ВРК. На рисунку 2 представлено заснований на чинних рекомендаціях практичний алгоритм персоналізованого вибору антиагрегантної стратегії для пацієнтів після ЧКВ залежно від ризику ішемії та кровотечі [10].
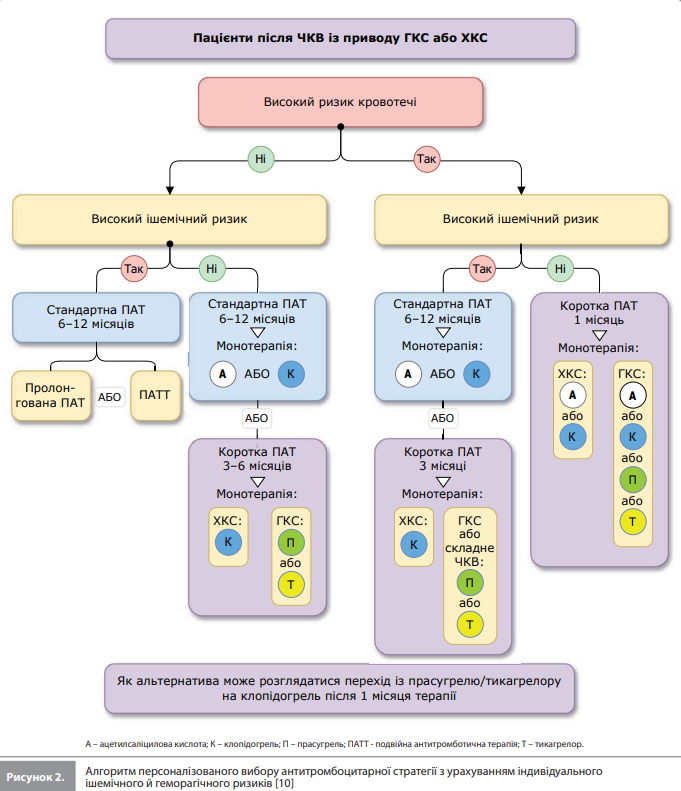
Згідно із цим алгоритмом у пацієнтів без високого геморагічного ризику кращий варіант включає використання ПАТ стандартної тривалості, тоді як коротку ПАТ із подальшим переходом на монотерапію іP2Y12 слід розглядати як альтернативний варіант для пацієнтів без високого ішемічного ризику, щоб уникнути надлишкового ефекту стандартної ПАТ. В основі цього підходу лежить низка міркувань, що стосуються знакових досліджень, які порівнювали монотерапію іP2Y12 із ПАТ. По-перше, у більшості цих досліджень оцінювали вплив монотерапії на загальну частоту несприятливих клінічних (ішемічних і геморагічних) подій або на загальну частоту ішемічних подій, що знижує ефективність виявлення відмінностей за впливом на окремі тромботичні та ішемічні кінцеві точки. По-друге, незважаючи на те, що кілька метааналізів підтвердили зниження ризику кровотеч і відсутність відмінностей за впливом на ішемічні події між монотерапією іP2Y12 і стандартною ПАТ, на ці об'єднані дані поширюються серйозні обмеження окремих досліджень [33–36], зокрема низький або помірний ризик ішемічних подій у більшості учасників досліджень, що обмежувало силу позитивних результатів, які спостерігалися в більш складних пацієнтів. Водночас, з'являється дедалі більше даних на користь використання короткої ПАТ (1–3 місяці) у пацієнтів із високим геморагічним ризиком [32, 56], тому схему із застосуванням короткої ПАТ і подальшим переходом на монотерапію іP2Y12, очевидно, доцільно використовувати як стратегію за замовчуванням у пацієнтів із високим геморагічним і низьким / помірним ішемічним ризиком [32, 56], а також як альтернативу стандартній ПАТ у пацієнтів із ВРК і супутнім високим ризиком ішемії на основі оцінки балансу між двома цими ризиками. Монотерапію АСК також можна розглядати як варіант лікування після короткочасної ПАТ [1, 55]: хоче ефекті монотерапії іP2Y12 і монотерапії АСК після короткої ПАТ і не порівнювали в жодному дослідженні, у кількох РКД схема із застосуванням монотерапії АСК знижувала ризик кровотеч без збільшення загальної кількості ішемічних подій порівняно зі стандартною ПАТ [57]. Проте важливо врахувати, що монотерапію АСК після ЧКВ досліджували переважно після 6-місячної ПАТ серед пацієнтів із низьким ішемічним ризиком [57–60]. Крім того, монотерапія АСК після короткої ПАТ була пов’язана з тенденцією до вищого ризику ІМ порівняно зі стандартною ПАТ серед пацієнтів із ГКС [61–63] і (за даними непрямих порівнянь) із вищим ризиком ІМ порівняно з монотерапією іP2Y12 [42]. З огляду на ці дані, монотерапію АСК після короткої ПАТ доцільно розглядати тільки в пацієнтів із високим геморагічним ризиком, котрі не належать до групи високого ризику ішемічних ускладнень. Вибір оптимальної антитромбоцитарної монотерапії для призначення після скасування стандартної ПАТ із метою довгострокової вторинної профілактики СС подій досі залишається дискусійним питанням. У цьому контексті нові дослідження показали вищу ефективність і зіставну безпечність монотерапії іP2Y12 порівняно з монотерапією АСК під час застосування після ГКС, що дало змогу сформулювати рекомендацію класу IIb щодо використання довготривалої монотерапії іP2Y12 як альтернативи монотерапії АСК [55]. І, нарешті, окрім стратегії вкорочення ПАТ із подальшим переходом на монотерапію АСК або іP2Y12, існує ще одна стратегія деескалації ПАТ, яка полягає в переході з прасугрелю або тикагрелору на клопідогрель невдовзі після ЧКВ, що дає змогу знизити ризик кровотеч і загальної кількості ішемічних подій порівняно зі стандартною ПАТ. Згідно з результатами мережевого метааналізу переведення пацієнта на менш потужний іP2Y12 порівняно зі стратегією вкорочення ПАТ із подальшою монотерапією АСК або іP2Y12 асоціюється зі зниженням загальної кількості несприятливих подій [64], що підтримує використання цього підходу як можливої альтернативи короткої ПАТ в окремих пацієнтів із ГКС, яким не підходять потужніші іP2Y12.
Практичні питання монотерапії іP2Y12 При виборі антитромбоцитарного режиму на основі короткої ПАТ із подальшою монотерапією іP2Y12 перед лікарем постає низка практичних питань, деякі з яких досі не мають однозначної відповіді. Серед них питання вибору конкретного іP2Y12 для монотерапії після короткої ПАТ, вибору оптимальної тривалості ПАТ перед переходом на монотерапію іP2Y12, а також оптимальної тривалості монотерапії іP2Y12 поза межами періоду, що вивчався в дослідженнях, питання щодо того, чи слід у разі призначення монотерапії тикагрелором у дозі 90 мг підтримувати цей режим постійно, чи доцільно пізніше перевести пацієнта на дозу 60 мг, або на приймання АСК чи клопідогрелю, а також питання щодо перипроцедурного застосування монотерапії іP2Y12 у пацієнтів із показаннями до непланових хірургічних операцій. Для формулювання чітких відповідей на ці питання потрібні подальші клінічні дослідження і наукові дискусії. Наразі проводиться низка нових досліджень безаспіринових підходів до лікування хворих після ЧКВ, зокрема чотири дослідження щодо порівняння монотерапії іP2Y12 після 1- і 3-місячної ПАТ зі стандартною 12-місячною ПАТ у пацієнтів після ГКС, два дослідження з вивчення ефектів монотерапії тикагрелором або прасугрелем після дуже короткої (що охоплює період перед і одразу після ЧКВ) ПАТ у пацієнтів із ГКС, а також одне дослідження з оцінки монотерапії клопідогрелем порівняно з пролонгованою ПАТ через ≥9–12 місяців після ЧКВ у пацієнтів із високим ішемічним ризиком, і одне східно-азійське дослідження щодо порівняння ефективності клопідогрелю і АСК у пацієнтів із високим ризиком повторних ішемічних подій через ≥12 місяців після ЧКВ [10].
Висновки Результати кількох РКД, незважаючи на деякі обмеження, загалом підтримують використання безаспіринового підходу, що передбачає перехід на монотерапію іP2Y12 після нетривалої ПАТ, як альтернативу стандартній ПАТ в окремих пацієнтів після ЧКВ. Зокрема, застосування цієї стратегії може бути доцільним у пацієнтів без високого ризику кровотечі та ішемії, а також є привабливим варіантом для пацієнтів із ВРК. Проте досі залишається невирішеною низка важливих питань, які потребують подальшого вивчення безаспіринових стратегій у рандомізованих клінічних дослідженнях і обговорення в широкому колі спеціалістів.
Список літератури знаходиться в редакції
Автор огляду Олена Грибова Medicine Review 2024; 2 (75): 10 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2024. Усі права захищені.
|
мапа сайту корисні посилання |