Оцінка залежності ефектів дапагліфлозину при серцевій недостатності від фонової терапії: ретроспективний аналіз результатів DAPA-HFНаразі застосування інгібіторів натрійзалежного котранспортера глюкози 2 типу (іНЗКТГ2) є одним з основних компонентів терапії при серцевій недостатності (СН) зі зниженою фракцією викиду (ФВ), що підтверджено рекомендаціями практичних настанов провідних медичних співтовариств, зокрема рекомендацією класу І (рівень доказовості А) у настанові Європейського товариства кардіологів (ESC) із ведення СН від 2021 року [1]. Підставою цієї рекоменда ції стали результати клінічних досліджень двох основних представників іНЗКТГ2 – емпагліфлозину й дапагліфлозину, що довели статистично й клінічно значуще зниження серцево-судинної (СС) смертності та захворюваності, пов’язаної з СН, на тлі такої терапії в пацієнтів із раніше діагностованою СН зі зниженою ФВ (СНзнФВ). Зокрема, для дапагліфлозину основним клінічним дослідженням за СНзнФВ стало плацебо-контрольоване дослідження DAPA-HF (Dapagliflozin And Prevention of Adverse Оutcomes in Heart Failure), у якому його застосування привело до зниження ризику комбінації погіршення перебігу СН і СС смерті та зменшило тяжкість симптомів у 4744 пацієнтів із СНзнФВ [2, 3], при цьому, як показав подальший ретроспективний аналіз даних DAPA-HF, проведений Docherty et al., корисні ефекти дапагліфлозину були адитивними, тобто доповнювали ефекти фонової науково-обґрунтованої медикаментозної та апаратної терапії (НОМТ), яку застосовували в учасників DAPA-HF для лікування СНзнФВ [4]. Основну інформацію про цей аналіз стисло подано в статті.
Методологія аналізу Docherty et al. DAPA-HF було проспективним рандомізованим подвійним сліпим плацебо-контрольованим клінічним дослідженням за участі хворих на СНзнФВ, у якому оцінювали ефективність і безпеку дапагліфлозину 10 мг один раз на день, доданого до стандартного лікування СН, порівняно з відповідним плацебо. У дослідженні брали участь чоловіки та жінки віком 18 років і понад із СН, симптомами II–IV функціонального класу (ФК) за класифікацією Нью-Йоркської кардіологічної асоціації (NYHA), ФВ лівого шлуночка (ФВ ЛШ) ≤40%, які, на думку дослідника, отримували оптимальну та узгоджену з місцевими рекомендаціями фармакологічну й апаратну терапію СНзнФВ (тобто НОМТ), а саме: 1) інгібітор ангіотензинперетворювального ферменту (іАПФ), або блокатор рецепторів ангіотензину (БРА), або комбінацію сакубітрил / валсартан; 2) бета-адреноблокатор (БАБ); 3) антагоніст мінералокортикоїдних рецепторів (АМР) за відсутності протипоказань або непереносимості. Ще один критерій включення до дослідження ґрунтувався на значенні концентрації N-термінального фрагмента попередника натрійуретичного пептиду B-типу (NT-proBNP), яка мала бути ≥600 пг/мл (або ≥400 пг/мл, якщо впродовж попередніх 12 місяців у пацієнта була госпіталізація з приводу СН [гСН]). У пацієнтів із фібриляцією (ФП) або тріпотінням передсердь мав бути рівень NT-proBNP ≥900 пг/ мл, незалежно від анамнезу гСН. До участі в дослідженні не допускали пацієнтів із симптомами гіпотензії або рівнем систолічного артеріального тиску (АТ) <95 мм рт. ст., розрахунковою швидкістю клубочкової фільтрації <30 мл/хв/1,73 м2 (або швидким зниженням функції нирок), цукровим діабетом (ЦД) 1 типу та іншими станами, що могли зашкодити участі пацієнта в дослідженні або значно скоротити очікувану тривалість життя [4]. Первинною кінцевою точкою (ПКТ) дослідження DAPAHF була комбінація епізоду погіршення перебігу СН і СС смерті (реєстрували першу із цих подій). Під погіршенням перебігу СН розуміли незаплановану госпіталізацію в стаціонар або терміновий візит до лікаря, що призвів до внутрішньовенної терапії СН. У своєму аналізі Docherty et al. оцінювали вплив дапагліфлозину порівняно з плацебо на ПКТ DAPA-HF, СС смерть як її окремий компонент і зміну частки пацієнтів, у яких спостерігали клінічно значуще (на ≥5 балів) поліпшення або погіршення загального показника симптомів (total symptom score, TSS) за шкалою Канзаського опитувальника для хворих на кардіоміопатію (KCCQ) через 8 місяців після рандомізації в дослідженні. Як показники безпеки терапії оцінювали зміну систолічного АТ, рівня сироваткового креатиніну, а також частоту розвитку гіповолемії та небажаних явищ (НЯ) із боку нирок [4].

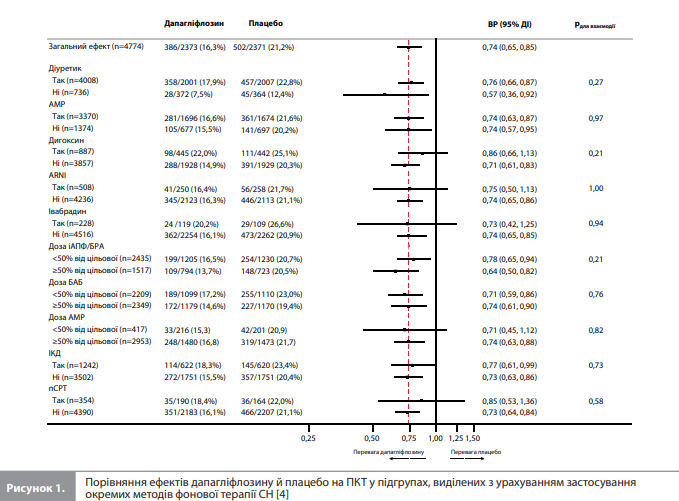
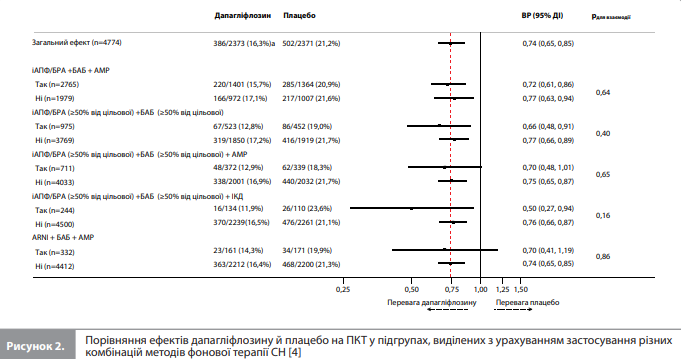
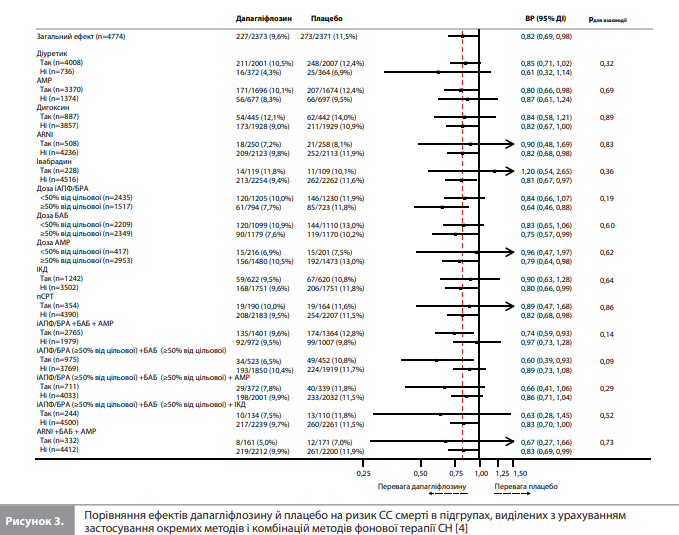
Оцінювання ефектів дапагліфлозину на кінцеві точки в аналізі Docherty et al. проводили в підгрупах пацієнтів, які отримували різні варіанти фонової терапії СН. З усіх можливих підгруп учасників, заснованих на типі фонової терапії, оцінювали тільки підгрупи розміром >200 осіб. Аналізи в усіх підгрупах, крім виділених з урахуванням використання БАБ та інгібіторів ренін-ангіотензинової системи (іРАС), були спрямовані на порівняння ефектів досліджуваної терапії за присутності та за відсутності певного фонового препарату/терапії (тобто порівняння «так vs ні»). Цей принцип застосовували до таких варіантів НОМТ, як діуретики, глікозиди наперстянки (далі сукупно – «дигоксин»), АМР, комбінація сакубітрил/ валсартан (далі – ARNI), івабрадин, використання імплантованого кардіовертера-дефібрилятора (ІКД) або пристрою для серцевої ресинхронізуючої терапії (пСРТ). Оскільки частка учасників, які не отримували БАБ або іРАС, була дуже малою, оцінку ефектів досліджуваної терапії в контексті використання цих фонових препаратів проводили відповідно до дози БАБ і іРАС на вихідному рівні, порівнюючи підгрупи, які отримували ≥50% від цільової дози, із підгрупами, які отримували <50% від цільової дози цих препаратів. За допомогою такого ж методу додатково проаналізували результати серед пацієнтів, які отримували АМР. Цільові добові дози фонових препаратів брали із чинних настанов (табл.) [4]. Вихідні характеристики груп порівнювали з використанням критерію Краскела-Уолліса й критерію χ2 для безперервних і категоріальних змінних відповідно. Вплив дапагліфлозину порівняно з плацебо на кожну кінцеву точку обчислювали у вигляді відношень ризиків (ВР) і 95% довірчих інтервалів (ДІ), отриманих із моделей пропорційних ризиків Кокса, стратифікованих відповідно до статусу ЦД і скоригованих із урахуванням наявності гСН в анамнезі та групи лікування. Значення р<0,05 указувало на статистичну значущість отриманих результатів [4].

Результати аналізу Docherty et al. Аналіз вихідних характеристик показав, що більшість учасників DAPA-HF отримували діуретики (84%), іРАС (94%) і БАБ (96%). Серед пацієнтів, які отримували іРАС (n=3952), 1517 (38%) приймали дозу, що становить ≥50% від рекомендованої цільової дози. Серед учасників, які отримували БАБ (n=4558), 2349 (52%) приймали дозу, що становить ≥50% від рекомендованої цільової дози. Загалом 71% учасників отримували АМР, 19% – дигоксин, у 26% був встановлений дефібрилятор і у 7% – пСРТ. Більшість пацієнтів (96%) приймали принаймні два препарати з трьох основних класів НОМТ – іАПФ/БРА/ARNI, БАБ та/або АМР, утім 3091 (65%) учасник отримував препарати всіх трьох зазначених класів [4]. Аналіз вихідних характеристик учасників з урахуванням фонової терапії. Docherty et al. згрупували вихідні характеристики учасників DAPA-HF відповідно до препаратів і комбінацій препаратів для НОМТ, зареєстрованих на вихідному рівні. Аналіз цих даних показав, що порівняно із загальною вибіркою учасників DAPA-HF пацієнти, які отримували дигоксин, відрізнялися нижчою ФВ ЛШ. Водночас, порівняно з підгрупами, які отримували інші препарати НОМТ, підгрупа дигоксину демонструвала більші частки пацієнтів із вищими значеннями ФК за NYHA, гірші оцінки симптомів (згідно з оцінкою TSS-KCCQ), найвищий рівень NT-proBNP і найбільші значення частоти попередньої гСН і частоти ФП. Майже такі самі тенденції (за винятком частоти ФП) спостерігали в підгрупах пацієнтів, які отримували діуретики й АМР, до того ж у цих двох підгрупах (а особливо в підгрупі сечогінної терапії) відмічалися гірші показники функції нирок порівняно із загальною вибіркою DAPA-HF. Пацієнти, які отримували ARNI, із більшою ймовірністю мали імплантований пристрій (ІКД та/або пСРТ), а також вирізнялися нижчою середньою ФВ ЛШ і медіанною концентрацією NT-proBNP порівняно із загальною вибіркою. Пацієнти, які отримували івабрадин, рідше приймали БАБ або мали ФП порівняно із загальною вибіркою DAPAHF. Приймання ≥50% від цільової дози іРАС асоціювалося з вищим систолічним АТ і нижчими медіанними значеннями концентрації NT-proBNP та оцінки TSS-KCCQ порівняно із загальною вибіркою DAPA-HF. Пацієнти з підгрупи БАБ, які приймали ≥50% від цільової дози препарату, майже не відрізнялися за своїми характеристиками від загальної вибірки DAPA-HF, за винятком нижчої оцінки TSS-KCCQ. Серед пацієнтів з ІКД/пСРТ було менше жінок (особливо з ІКД), і ці пацієнти були загалом старші, демонстрували гіршу оцінку TSS-KCCQ і нижчу ФВ ЛШ порівняно із загальною вибіркою DAPA-HF. Використання пСРТ асоціювалося з вищою медіанною концентрацією NT-proBNP, гіршою функцією нирок і вищою ймовірністю гСН у минулому порівняно із загальною вибіркою учасників [4]. Ефект дапагліфлозину залежно від фонової терапії. Вплив дапагліфлозину порівняно з плацебо на частоту комбінованої ПКТ і на ризик СС смерті залежно від характеру фонової терапії демонструють рисунки 1–3 [4]. Як видно із цих графіків, перевага дапагліфлозину над плацебо за впливом на ПКТ (рис. 1, 3) і ризик СС смерті (рис. 2) була стабільною в усіх підгрупах, виділених з урахуванням варіантів фонової терапії включно з діуретиком, дигоксином, АМР, ARNI, івабрадином та ІКД/пСРТ, без ознак значущої взаємодії між фоновою терапією та ефектом дапагліфлозину [4]. Оцінка ефекту дапагліфлозину порівняно з плацебо залежно від дози іАПФ/БРА, БАБ і АМР показала, що доза зазначених препаратів (≥50 vs <50% від цільової) не впливала на величину ефекту дапагліфлозину на досліджувані кінцеві точки (рис. 1–3) [4]. Аналогічні результати показали аналізи залежності ефектів дапагліфлозину від застосування різних комбінацій препаратів/пристроїв для фонової терапії (рис. 2, 3) [4]. Величина ефекту дапагліфлозину залишалася стабільною при порівнянні будь-яких двох підгруп, виділених на підставі отримання і неотримання будь-якої комбінації фонових препаратів. Вплив дапагліфлозину на симптоми СН залежно від фонової терапії. Через 8 місяців після рандомізації частка учасників із клінічно значущим покращенням стану (збільшення оцінки TSS-KCCQ на ≥5 балів) була значно вищою, а частка учасників із клінічно значущим погіршенням стану (зменшення оцінки TSS-KCCQ на ≥5 балів) – значно нижчою в групі дапагліфлозину порівняно з групою плацебо, і цей ефект дапагліфлозину був стабільним у всіх підгрупах, виділених з урахуванням приймання препаратів / комбінацій препаратів фонової терапії (для всіх порівнянь рдля взаємодії >0,1) [4].
Безпека дапагліфлозину залежно від фонової терапії. Через 8 місяців після рандомізації застосування дапагліфлозину асоціювалося зі зниженням рівня АТ порівняно з плацебо без ознак суттєвої залежності цього ефекту від характеру фонової терапії. Аналогічну тенденцію спостерігали для невеликого збільшення рівня сироваткового креатиніну в групі дапагліфлозину порівняно з плацебо через 8 місяців лікування [4]. У пацієнтів, які отримували діуретик, НЯ, пов’язані з гіповолемією, розвивалися частіше при застосуванні дапагліфлозину порівняно з плацебо, утім найменше таких явищ було в підгрупі пацієнтів, які не отримували діуретик, але приймали дапагліфлозин; тобто ефект дапагліфлозину на цей ризик залежав від приймання діуретика (рдля взаємодії=0,004). Значущу взаємодію між ефектом дапагліфлозину на ризик НЯ, пов’язаних із гіповолемією, і фоновою терапією також спостерігали для приймання АМР у дозі ≥50% від цільової (рдля взаємодії=0,01), приймання комбінації іРАС + БАБ + АМР (рдля взаємодії=0,02), а також комбінацій, що включали приймання іРАС і БАБ у дозах ≥50% від цільової (рдля взаємодії від <0,001 до 0,04) [4]. Ниркові НЯ рідше реєструвалися в групі дапагліфлозину порівняно з плацебо серед пацієнтів, які не отримували сечогінну терапію, і не демонстрували міжгрупових відмінностей серед пацієнтів, які отримували діуретик на вихідному рівні. Водночас приймання іРАС у дозі ≥50% від цільової (окремо або у складі комбінацій) збільшувало ймовірність розвитку ниркових НЯ на тлі терапії дапагліфлозином порівняно з хворими, які отримували іРАС у дозі <50% від цільової [4].
Обговорення результатів аналізу Docherty et al. Коли стає зрозуміло, що новий препарат або метод покращує результати терапії досліджуваного захворювання, одразу постає питання, чи є цей корисний ефект дійсно адитивним, тобто таким, що доповнює переваги стандартних методів лікування. У контексті представлених результатів аналізу DAPA-HF немає жодних сумнівів, що дапагліфлозин насправді забезпечує додаткову користь у лікуванні СНзнФВ за умов додавання до доведено ефективної фонової терапії, що включає приймання іРАС, БАБ і АМР. Більше того, згідно з отриманими результатами, іНЗКТГ2 дапагліфлозин також доповнює ефекти двох інших нових препаратів для лікування СН – івабрадину й ARNI. Той факт, що жоден із препаратів із категорії НОМТ не змінив відповідь пацієнтів на терапію дапагліфлозином, підтверджує думку, згідно з якою інгібування натрійзалежного котранспортера глюкози 2 типу є незалежним механізмом лікування СН і доповнює інші механізми корекції порушень, пов’язаних із СНзнФВ. Згідно із сучасними уявленнями, основу корисних ефектів іНЗКТГ2 на перебіг СНзнФВ становлять діуретичний ефект, збільшення секреції еритропоетину нирками, зменшення вираженості фіброзу міокарда, а також потенційний вплив на периферичні судини, іонні транспортери, адипокіни й активність симпатичної нервової системи [5]. У своїй роботі Docherty et al. проаналізували ефекти дапагліфлозину ще в одному важливому контексті, а саме залежно від адекватності наявної фонової терапії, тобто перевірили, чи не пов’язана спостережувана перевага іНЗКТГ2 над плацебо з тим, що учасники приймали недостатні (порівняно з цільовими) дози НОМТ, або з тим, що в їхньому лікуванні необґрунтовано не використовували пристрої для апаратної терапії. Добре відомо, що, попри наявність доведено ефективних значень цільових доз для іРАС і БАБ, а також доведений зв’язок між дозою, яку приймають, і ефектом іРАС (щонайменше для гСН) [6, 7], у клінічній практиці таких цільових доз досягає мала частка пацієнтів і не завжди через непереносимість вищих доз [8, 9]. Так само ІКД і пСРТ недостатньо використовуються на практиці у хворих із показаннями до такої терапії [10–12]. Утім результати представленого аналізу показують, що ефективність дапагліфлозину залишається стабільною незалежно від величини дози застосовуваних препаратів для НОМТ (≥ або <50% від цільової) і застосування/незастосування ІКД/пСРТ і не зменшується в умовах оптимізованої фонової терапії [4].
Висновок Отже, ретроспективний аналіз результатів дослідження DAPA-HF, проведений Docherty et al., показав, що вираженість сприятливого ефекту іНЗКТГ2 дапагліфлозину на ризик комбінації СС смерть + погіршення перебігу СН і ризик СС смерті у хворих на СНзнФВ порівняно з плацебо не залежить від фонової медикаментозної та апаратної терапії. Отримані результати підтверджують, що ефекти дапагліфлозину посилюють традиційну терапію СНзнФВ, і підтримують відношення до іНЗКТГ2 як до препаратів першого вибору в умовах СН.
Список літератури знаходиться в редакції
Автор огляду Наталія Генш Medicine Review 2025; 2 (83): 12 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2026. Усі права захищені.
|
мапа сайту корисні посилання |