Вибір антиаритмічного препарату для довгострокової терапії фібриляції передсердь: акцент на стан щитовидної залозиФібриляція передсердь (ФП) – одна з найбільш поширених клінічно значущих серцевих аритмій. Захворюваність на ФП становить 0,5% у людей віком від 40–50 років і збільшується до 5–15% після досягнення 80–89 років [1–5]. ФП має дуже складну патофізіологію і знаходиться в сильній залежності від фонових серцевих та екстракардіальних захворювань, у тому числі від патології щитовидної залози (ЩЗ). Відомо, що однією з умов збереження структури серця та функції серцевосудинної системи є нормальні рівні тиреоїдних гормонів, тоді як при дисфункції ЩЗ (гіпо-, гіпертиреоз) у міокарді виникають структурно-функціональні зміни, здатні призвести до розвитку ФП [7–9]. За наявними даними, ФП – найчастіше порушення серцевого ритму у хворих із гіпертиреозом із поширеністю до 20% [10]. Гіпотиреоз також підвищує ризик розвитку ФП – безпосередньо або через розвиток серцевої недостатності, частої супутниці миготливої аритмії [9, 11, 12]. При цьому на серце впливає не лише клінічно виражена тиреоїдна дисфункція, а й субклінічний гіпо-, гіпертиреоз. Захворювання ЩЗ дуже поширені в Україні, що пов’язано із цілою низкою чинників, серед яких несприятлива екологічна ситуація, радіаційні техногенні катастрофи, високі психоемоційні навантаження населення та розбалансованість добових раціонів [13–16]. Ситуацію посилює зумовлений географічним розташуванням України йододефіцит, якому піддаються до 70% населення країни [17]. Нестача йоду пов’язана з розвитком йододефіцитних захворювань, як-от різні форми зобу (дифузний, вузловий) та гіпотиреоз [18, 19]. Крім того, проблема йододефіциту тісно пов’язана з проблемою йодіндукованих захворювань, що виникають унаслідок неправильної профілактики недостатності йоду за допомогою йодованих продуктів, йодованої солі та йодовмісних препаратів. В умовах надлишкового надходження йоду в організм можуть розвиватися аутоімунний тиреоїдит і тиреотоксикоз [20]. Імовірність наявності в кардіологічного пацієнта захворювання ЩЗ є дуже високою, і це слід ураховувати у разі ведення хворих із ФП. Потенційні складності, пов’язані з подібним коморбідним фоном, зумовлені підвищенням ризику рецидивів ФП та тиреоїдних ускладнень довгострокової антиаритмічної терапії.
Профілактика рецидивів ФП за допомогою антиаритмічних препаратів Метою довгострокової терапії миготливої аритмії із застосуванням антиаритмічних препаратів (ААП) є підтримання синусового ритму (СР) та профілактика рецидивів ФП. Таке лікування гальмує електричне ремоделювання міокарда, уповільнюючи прогресування ФП, покращує показники гемодинаміки за допомогою відновлення скоротливої функції передсердь, підвищує якість життя через контроль симптомів захворювання та підвищення толерантності до фізичного навантаження, а також знижує ризик розвитку тромбоемболічних ускладнень ФП. Нині стратегію відновлення та підтримки СР вважають пріоритетною і активно застосовують у лікуванні більшості пацієнтів із пароксизмальною та персистуючою формами ФП за відсутності вираженої органічної патології серця. У більшості європейських країн із цією метою використовують ААП флекаїнід, соталол, пропафенон і аміодарон, при цьому внаслідок мінімального ризику розвитку проаритмії та більшої сили доказів на користь антиаритмічної ефективності перевага надається двом останнім ААП (пропафенону та аміодарону) [6, 21, 22]. Слід зазначити, що обираючи із цих двох ААП, лікарі часто орієнтуються лише на антиаритмічну активність, приділяючи недостатньо уваги профілю безпеки препарату. Відомо, що антиаритмічна ефективність аміодарону в профілактиці рецидиву ФП дещо вища за ефективність пропафенону: кількість пацієнтів, яких треба пролікувати протягом року для профілактики одного рецидиву миготливої аритмії, становить 3 для аміодарону та 5 – для пропафенону [6, 21]. Тим не менш, в аміодарону є побічні ефекти, на які не можна не зважати, особливо у пацієнтів із ФП у комбінації з клінічними / субклінічними захворюваннями ЩЗ.

Тиреотоксичні ефекти та антиаритмічна активність аміодарону Аміодарон (антиаритмік III класу, що на додаток має ефекти І, ІІ та ІV класів ААП) – жиророзчинне йодовмісне похідне бензофурану, структурно схоже на гормон ЩЗ тироксин. Під час використання стандартної дози аміодарону (200 мг/добу) пацієнти отримують щодня 75 мг йоду, що в рази перевищує рекомендовану щоденну дозу мікроелемента, яка дорівнює 150–200 мкг [23]. Надмірне навантаження йодом, що порушує процес утворення тиреоїдних гормонів, є одним із механізмів розвитку аміодаронасоційованої дисфункції ЩЗ. Другий механізм пов’язаний із самостійними проапоптотичним та цитотоксичним ефектами аміодарону і його активного метаболіту діетиламіодарону на тканину ЩЗ, що доповнюють цитотоксичну активність йоду [24–27]. За даними гістопатологічних досліджень, застосування аміодарону супроводжується порушеннями структури ЩЗ з лізисом, некрозом і апоптозом тиреоцитів, порушенням архітектоніки тиреоїдної тканини, відкладенням ліпофусцину і розширенням ендоплазматичної мережі [28–30]. Передбачається, що ранній токсичний ефект аміодарону на ЩЗ призводить, крім іншого, до вивільнення аутоантигенів і подальшого запуску імунних реакцій, що може стати причиною індукції або маніфестації аутоімунних змін в ЩЗ. Надлишкове навантаження йодом (перший механізм) викликає аміодаронасоційований гіпотиреоз (ААГ) і аміодаронасоційований тиреотоксикоз (ААТ) 1 типу (зумовлений йодіндукованим підвищенням синтезу тиреоїдних гормонів в існуючих зонах автономії в ЩЗ), цитотоксичний / проапоптотичний ефект препарату (другий механізм) запускають розвиток ААТ 2 типу (деструктивний тиреоїдит із викидом гормонів із пошкоджених ділянок ЩЗ) [31]. Виявлено взаємозв’язок між типом аміодаронасоційованої тиреоїдної дисфункції та фоновим станом ЩЗ. Так, ААГ розвивається або в людей із початково здоровою ЩЗ, або (частіше, приблизно в 71% випадків [30]) у хворих із хронічним аутоімунним тиреоїдитом; ААТ 1 типу спостерігається переважно у хворих із вихідною патологією ЩЗ, у тому числі вузловий зоб, автономія ЩЗ або дифузний токсичний зоб; ААТ 2 типу виникає виключно в людей із початково здоровою ЩЗ [32–34]. У цілому, аміодаронасоційована дисфункція ЩЗ відзначається у 15–20% хворих, які приймають цей ААП [31]. Слід зазначити, що поширеність тиреоїдних побічних ефектів аміодарону в різних країнах залежить від рівня споживання йоду в тій чи іншій країні: ААГ спостерігається найчастіше в регіонах із достатнім і високим споживанням йоду, ААТ – у йододефіцитних областях [30, 31]. При цьому ААГ частіше розвивається на ранніх етапах терапії аміодароном, тоді як ААТ може виникнути на будь-якому етапі лікування, навіть через місяці після відміни препарату через тривалий період напіввиведення (у середньому 100 діб) та повільне вивільнення аміодарону та його метаболітів із депо [34–36]. ААТ є більш небезпечною формою дисфункції ЩЗ, ніж ААГ, оскільки гіпертиреоз негативно впливає на стан серця та перебіг основного захворювання і, крім того, може змінювати активність антикоагулянтних препаратів із групи антагоністів вітаміну К та антиаритмічну активність самого аміодарону [30, 37, 38]. ААГ зазвичай не вимагає відміни аміодарону і коригується замісною терапією L-тироксином. У хворих без фонової патології ЩЗ функція органу після відміни аміодарону, як правило, відновлюється, у хворих з аутоімунним тиреоїдитом висока ймовірність перманентного гіпотиреозу навіть після відміни ААП [31–33]. Препаратами для лікування ААТ є тіонаміди (ААТ 1 типу та змішані форми) і глюкокортикоїди (ААТ 1 та 2 типу). Якщо це можливо з точки зору контролю над серцевою аритмією, терапія аміодароном у хворих з ААТ має бути припинена, оскільки подальше приймання ААП може сповільнити повернення до еутиреозу та підвищити ризик рецидиву тиреотоксикозу після відміни глюкокортикоїдних препаратів. Можливість безпечного відновлення терапії аміодароном після відновлення еутиреозу на цей час не визначена [30, 31]. Пацієнтам з ААТ на тлі нестабільного захворювання серця (необхідність швидкого відновлення еутиреозу) або у разі рецидивного / стійкого тиреотоксикозу може знадобитися тотальна тиреоїдекомія [39–42]. Аміодарон є активним ААП із загальним показником антиаритмічної ефективності 50–78%, проте ризик токсичного впливу на ЩЗ та інших аміодаронасоційованих побічних ефектів обов’язково треба враховувати у разі призначення цього препарату для довгострокової терапії ФП [43].
Безпека та антиаритмічна ефективність пропафенону Пропафенон належить до ААП класу IC. Маючи широкий діапазон електрофізіологічних властивостей, поряд із блокадою натрієвих каналів, препарат істотно впливає на активність адренорецепторів, а також калієвих і кальцієвих каналів [30]. Йод у структурі молекули пропафенону відсутній, сама по собі молекула ушкоджувальної дії на тканини ЩЗ і будь-якого впливу на функцію органу не має. У більшості клінічних досліджень пропафенон добре переносився, зумовлюючи розвиток лише незначних побічних ефектів [44–50]. Клінічні дослідження із застосуванням пропафенону для збереження СР у хворих із ФП довели здатність препарату значно збільшувати проміжок часу до рецидиву ФП. У плацебоконтрольованому дослідженні PSVT (UK Propafenone Paroxysmal Supraventricular Tachycardia) за участі пацієнтів із двома або більше рецидивами ФП середній час до рецидиву аритмії становив 11 днів у групі плацебо і більше 98 днів – у групі пацієнтів, які отримували пропафенон [51–53]. У порівняльних дослідженнях здатність пропафенону запобігати рецидиву пароксизмальної ФП була зіставною з можливостями флекаїніду і перевершувала ефекти хінідину й соталолу [44]. У ролі препарату для підтримки СР після кардіоверсії персистуючої ФП терапевтичний успіх пропафенону був аналогічний ефективності пероральних форм прокаїнаміду, дизопіраміду, флекаїніду, хінідину та соталолу [54–56]. Непряме порівняння пропафенону з одним із сучасних ААП дронедароном у рамках метааналізу Freemantle et al. [57] виявило, що пропафенон ефективніше запобігає рецидивам ФП, ніж дронедарон: показники відношення ризиків (ВР) для дронедарону і пропафенону порівняно з плацебо становили 0,59 (95% довірчий інтервал 0,45–0,76) і 0,29 (95% ДІ 0,16–0,55) відповідно. І, нарешті, при порівнянні пропафенону / соталолу з аміодароном у дослідженні CTAF (Canadian Trial of Atrial Fibril lation, n=403) аміодарон очікувано забезпечив меншу частоту рецидивів ФП, ніж пропафенон або соталол (р<0,001), при тому що частота побічних ефектів, що вимагали відміни препарату, була чисельно вищою в групі аміодарону [58]. Висока антиаритмічна активність пропафенону підтверджується даними з Кокранівського огляду, в якому пропафенон указаний як ААП, що ефективно запобігає рецидивам ФП (ВР рецидиву ФП) 0,37) [59].
Аміодарон vs пропафенон: акцент на тиреотоксичні ефекти Як зазначалося раніше, аміодарон є ефективним препаратом у профілактиці рецидивів ФП, однак поширені (розвиваються у 80% пацієнтів, які отримують аміодарон) потенційно серйозні і тривалі (можуть зберігатися до декількох місяців) екстракардіальні токсичні ефекти обмежують використання цього ААП, залишаючи його «препаратом останнього вибору» [43, 60–62]. У дослідженні CTAF частота відміни препарату через розвиток небажаних ефектів становила 18% у групі аміодарону і 11% – у групі соталолу / пропафенону (р=0,06). Серед 36 пацієнтів, які припинили лікування через небажані явища (НЯ) у групі аміодарону, у двох причиною відміни лікування став гіпотиреоз, і в одного – гіпертиреоз [58]. Схожі результати були отримані у двох дослідженнях Kochiadakis et al. Перше із цих досліджень порівнювало ефективність та безпеку аміодарону та пропафенону в профілактиці рецидиву ФП та підтримці СР у 146 пацієнтів із рецидивною симптоматичною ФП [63]. Пацієнти були рандомізовані на терапію аміодароном 200 мг/добу (n=72) або пропафеноном 450 мг/добу (n=74). Для кожного препарату оцінювалася частка пацієнтів із рецидивами ФП та/або НЯ, які вимагали відміни ААП. Серед 72 пацієнтів, які отримували аміодарон, рецидив ФП виник у 25 осіб порівняно з 33 із 74 пацієнтів, які отримували пропафенон. У 12 хворих, які отримували аміодарон, і у 2 – пропафенон, розвинулися НЯ, які вимагають відміни терапії. Отже, у цьому дослідженні аміодарон демонстрував тенденцію до більшої ефективності в плані збереження СР (р=0,058 за даними аналізу з рецидивом аритмії як кінцевої точки), але ця перевага нівелювалася підвищенням частоти НЯ, що вимагали відміни препарату (р=0,44 за даними аналізу з комбінацією рецидив ФП+НЯ як кінцевої точки). Серед 17 НЯ, зареєстрованих у цьому дослідженні у групі терапії аміодароном (12 випадків відміни препарату), 14 були з боку ЩЗ (8 випадків гіпотиреозу та 6 випадків гіпертиреозу). У групі пропафенону було два випадки скасування терапії через НЯ без порушень із боку ЩЗ [63]. Друге дослідження, виконане тією ж групою авторів, мало схожий дизайн і порівнювало ефекти аміодарону, соталолу і пропафенону в 214 пацієнтів із рецидивуючою симптоматичною ФП [64]. Серед 14 НЯ у групі аміодарону було 6 випадків гіпертиреозу та 4 – гіпотиреозу. У групі пропафенону було зареєстровано одне НЯ, що не мало відношення до ЩЗ [64]. Для оцінки ймовірності розвитку побічних ефектів терапії низькими дозами аміодарону (400 мг на добу) порівняно з плацебо Vicken et al. провели метааналіз чотирьох досліджень (подвійні сліпі плацебоконтрольовані дослідження з періодом спостереження мінімум 12 місяців), що включив дані на 1465 хворих [65]. Хворі з побічними ефектами ділилися на групи залежно від ураженого органу, у тому числі група НЯ з боку ЩЗ. Результати аналізу показали, що вплив аміодарону на ЩЗ у цьому діапазоні доз значно перевищував ефекти плацебо (ВР 4,2, 95% ДІ 2,0–8,7, р=0,001): вплив низьких доз аміодарону був пов’язаний із 4-кратним збільшенням ризику розвитку НЯ з боку ЩЗ, включно з клінічним гіпотиреозом, а також субклінічні форми дисфункції ЩЗ, що потребують лікування (рис.). Vicken та ін. зробили висновок, що використання аміодарону пов’язане з проблемою розвитку НЯ, яка може переважити його потенційно корисні антиаритмічні ефекти [65].
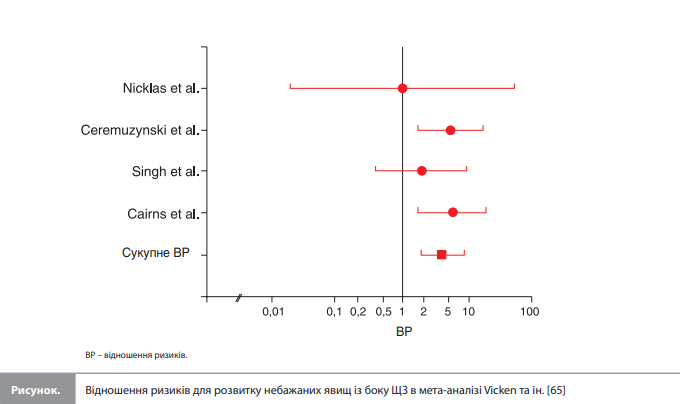
Висновок ФП є одним із найпоширеніших порушень серцевого ритму, а захворювання ЩЗ – провідною групою ендокринопатій в Україні, що робить можливим одночасну присутність ФП і захворювання ЩЗ в одного й того самого українського пацієнта. Імовірність такого коморбідного фону слід ураховувати в разі вибору препаратів для лікування ФП, оскільки патологія ЩЗ (у тому числі субклінічна форма ендокринопатії) може впливати на ефекти деяких ААП та профіль безпеки довгострокової антиаритмічної терапії
Список літератури знаходиться в редакції
Автор огляду Наталія Міцьо Medicine Review 2025; 2 (83): 36 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2026. Усі права захищені.
|
мапа сайту корисні посилання |