Сучасна тактика ведення пацієнтів із захворюваннями периферичних артерій та аорти: рекомендації з оновленої настанови ESC (2024)Влітку 2024 р. Європейська кардіологічна асоціація (ESC) випустила збірку клінічних рекомендацій щодо захворювань периферичних артерій (ЗПА) і хвороб аорти (ХА), яка являє собою оновлення відповідних настанов 2014 (ХА) та 2017 (ЗПА) років [1]. Це оновлення отримало схвалення експертів Європейської асоціації кардіоторакальної хірургії (EACTS), Європейської мережі медичних установ, що спеціалізуються на рідкісних мультисистемних судинних захворюваннях (VASCERN), і Європейського товариства судинної медицини (ESVM) [1]. Крім того, внесок у створення нової редакції документа зробили спільноти пацієнтів, які взяли участь в обговоренні показників клінічних результатів, які повідомляють пацієнти (patient-reported outcome measures, PROM), і показників клієнтських вражень, які повідомляють пацієнти (patientreported experience measures, PREM). В основі інтересу до ЗПА і ХА лежать їхня висока поширеність, а також пов’язані з ними високі захворюваність і смертність. В основу сучасної стратегії ведення таких пацієнтів автори поклали дві ключові концепції: ухвалення рішень спільно з пацієнтом і багатопрофільний підхід із веденням складних випадків і проведенням складних лікувальних процедур в експертних центрах із великою частотою їх виконання. У цій статті йдеться про основні нововведення і найважливіші зміни, представлені в настанові [1–3].
Скринінг і діагностика Для первинного скринінгу на наявність ЗПА, а саме атеросклеротичного захворювання артерій нижніх кінцівок, як перший тест рекомендують використовувати неінвазивний підхід, що ґрунтується на вимірі гомілково-плечового індексу (ГПІ) (рекомендація класу I, рівень доказовості B). Діагностичним критерієм ЗПА вважають ГПІ ≤0,9. Проте потрібно враховувати, що у пацієнтів із цукровим діабетом (ЦД) та/або хронічною хворобою нирок часто зустрічається ГПІ ≥1,4, що пов'язано з кальцифікацією середнього шару судинної стінки (артеріосклероз Менкеберга), тому при обстеженні таких пацієнтів рекомендують використовувати альтернативні індекси та методи, наприклад вимірювати тиск на рівні пальців ніг, розраховувати пальце-плечовий індекс або проводити аналіз форми сигналів, отриманих під час доплерографії (I, B). Загалом, єдиною групою пацієнтів, у яких рекомендовано розглядати (IIa, C) систематичний скринінг на ЗПА, є особи віком від 65 років із відповідними факторами ризику. У розділі, присвяченому діагностиці, автори настанови представили комплексний підхід, який включає оцінку стану всієї артеріальної частини судинного русла, тобто рекомендують одночасно оцінювати пацієнта на наявність ЗПА та ХА. На додаток до стандартних методів обстеження цей підхід передбачає використання спеціальних опитувальників для оцінки функціональної спроможності та виявлення депресивних розладів. У частині, присвяченій виявленню та оцінці стану пацієнтів з аневризмами грудного (АГА) і черевного (АЧА) відділів аорти, як скринінгові методи вказані трансторакальна (ТТ) ехокардіографія (ЕхоКГ) та ультразвукове дуплексне сканування (УЗДС) відповідно, а як методи діагностичного обстеження – ТТ або черезстравохідна (ЧС) ЕхоКГ + комп'ютерна томографія (КТ) або магнітно-резонансна томографія (МРТ) серця і судин для АГА й УЗДС із контрастом / без контрасту, а також КТ / МРТ судин і серця – для АЧА. Скринінг на АЧА за допомогою УЗДС рекомендують проводити в чоловіків-курців віком ≥65 років, у всіх чоловіків віком ≥75 років (незалежно від статусу куріння) та в жінок віком ≥75 років, якщо вони є активними курцями та/або мають артеріальну гіпертензію. Раніше скринінг у жінок проводили тільки серед колишніх / активних курців віком >65 років, і його не було показано жінкам, які не курять. Родичів пацієнтів з АЧА першого ступеня спорідненості віком ≥50 років слід обстежувати за допомогою УЗДС, якщо тільки не встановлена інша однозначна причина індексної АЧА. Тепер це рекомендація класу I (раніше була класу IIa).
Класифікація ЗПА У розглянутій версії настанови запроваджено клінічну класифікацію, яка поділяє ЗПА на три основні групи: безсимптомне ЗПА (зазвичай виявляють під час скринінгу), симптоматичне ЗПА (симптоми виникають під час фізичного навантаження), хронічна ішемія, що загрожує втратою кінцівки (охоплює пацієнтів з ішемічним болем у спокої) (рис. 1).
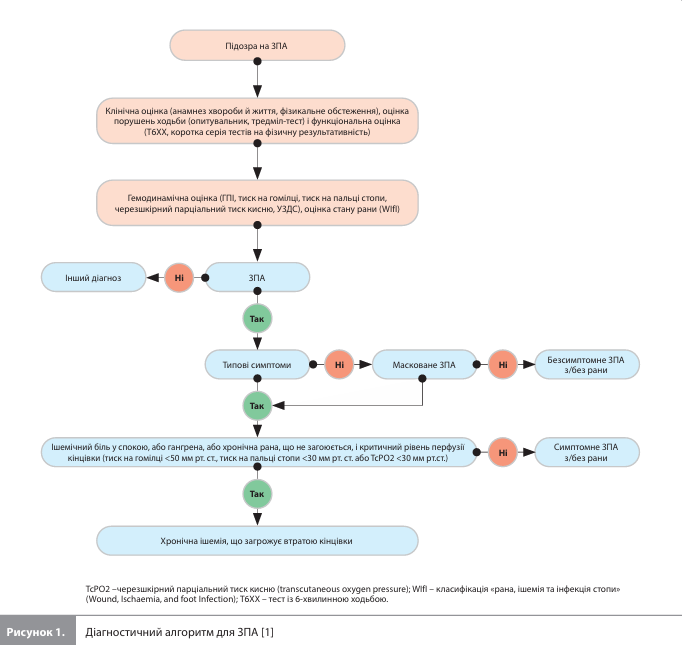
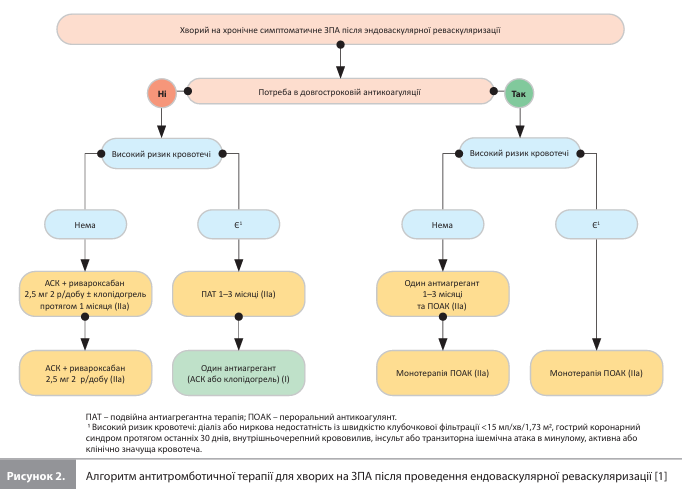
Терапія ЗПА Оптимальне ведення пацієнтів із ЗПА і ХА має бути комплексним і заснованим на поєднанні фармакотерапії та зміни способу життя. Основні зміни способу життя включають дотримання середземноморської дієти, регулярну фізичну активність для покращення функціональних можливостей і відмову від куріння для уповільнення прогресування захворювання. Навчання пацієнтів та їхня участь у структурованих програмах підтримки додатково залучають хворих до процесу терапії та підвищують прихильність до лікування, що додатково покращує клінічні результати. Фармакотерапія ЗПА і ХА спрямована на корекцію патофізіологічних порушень, зниження серцево-судинного (СС) ризику й уповільнення прогресування захворювання і включає антитромботичну, антигіпертензивну (за показаннями), гіполіпідемічну, протидіабетичну (за показаннями) терапію. Антитромботична терапія. За наявності безсимптомного ЗПА доступні дані не підтримують рутинне призначення антиагрегантів, при цьому в пацієнтів із ЦД, за відсутності протипоказань, можна розглядати призначення ацетилсаліцилової кислоти (АСК, 75–100 мг) (IIb, A). У пацієнтів із симптоматичним ЗПА кращим варіантом довгострокової терапії є монотерапія АСК або клопідогрелем (I, A). До настанови включено нову рекомендацію, згідно з якою в пацієнтів із ЗПА, які мають високий ішемічний ризик, супутні захворювання високого ризику (IIa, A) або перенесли реваскуляризацію нижніх кінцівок (IIa, B), слід розглядати застосування комбінації ривароксабану (2,5 мг двічі на день) та АСК (100 мг один раз на день), якщо не підвищений ризик кровотечі. Серед пацієнтів, у яких крім ЗПА є показання до довгострокової антикоагуляції, може розглядатися монотерапія пероральним антикоагулянтом (IIb). Рекомендації щодо антитромботичної терапії після ендоваскулярної реваскуляризації з приводу симптоматичного ЗПА представлені на рисунку 2.
Антигіпертензивна терапія. Цільові значення систолічного артеріального тиску (АТ) за ЗПА і ХА відповідають діапазону 120–129 мм рт. ст. (раніше цільовим був АТ <140/90 мм рт. ст.), водночас для літніх або ослаблених пацієнтів можуть підбиратися індивідуальні цільові показники. Препаратами першої лінії для зниження підвищеного АТ є інгібітори ангіотензинперетворювального ферменту і блокатори рецепторів ангіотензину. У багатьох випадках для досягнення оптимального контролю АТ потрібне призначення комбінованої терапії, що включає діуретики, бета-адреноблокатори та/або блокатори кальцієвих каналів. Гіполіпідемічна терапія. У пацієнтів з атеросклеротичними ЗПА і ХА терапевтичною метою є зниження концентрації холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) на 50% і досягнення цільового рівня ХС ЛПНЩ <55 мг/дл (раніше цільовий показник становив <70 мг/дл). Із цією метою всім пацієнтам із ЗПА рекомендують статини. Якщо монотерапія статином не знижує рівень ХС ЛПНЩ до цільових значень, до схеми лікування рекомендують додати езетиміб або інгібітори PCSK9. Якщо у пацієнта з непереносимістю статинів не вдається досягти цільового рівня ХС ЛПНЩ за допомогою монотерапії езетимібом, рекомендують перевести хворого на приймання комбінації езетиміб + бемпедоєва кислота або комбінації езетиміб + бемпедоєва кислота + інгібітор PCSK9. Протидіабетична терапія. За наявності ЗПА та ХА скринінг на ЦД або переддіабет має велике значення, оскільки за наявності ЦД / переддіабету оптимізована терапія суттєво покращує клінічні результати. При призначенні протидіабетичної терапії цільовий рівень глікованого гемоглобіну становить 7% (може бути вищим для пацієнтів із невеликою очікуваною тривалістю життя). Серед антигіперглікемічних препаратів перевагу мають інгібітори натрійзалежного котранспортера глюкози 2 типу й агоністи рецепторів глюкагоноподібного пептиду-1, які продемонстрували корисні СС ефекти. Лікувальна фізкультура. Оптимальна терапія симптоматичних ЗПА і ХА обов’язково має включати контрольовані тренування (supervised exercise training, SET) (I, А). Такі заняття безпечні та призводять до збільшення дистанції ходьби на біговій доріжці (як максимальної, так і безболісної), покращення якості життя, пов’язаної зі здоров’ям (ЯЖПЗ), і підвищення кардіореспіраторної витривалості, хоча й не збільшують ГПІ. Для досягнення корисних ефектів тренування SET необхідно проводити не рідше 3 разів на тиждень по 30–60 хвилин протягом щонайменше 12 тижнів. Також тренування SET настійно рекомендують як допоміжну терапію після ендоваскулярної реваскуляризації (I, A), оскільки вони значно покращують параметри ходьби та ЯЖПС, а також знижують ризик подальшої реваскуляризації. Коли контрольовані тренування недоступні, слід рекомендувати пацієнтам домашні тренування або альтернативні варіанти лікувальної фізкультури, наприклад силові тренування, заняття на тренажерах, зокрема для рук і верхньої частини тіла, їзду на велосипеді, скандинавську ходьбу та їхні комбінації (IIa, A). Докази щодо оптимальної інтенсивності фізичних тренувань менш надійні: з одного боку, високоінтенсивні вправи менш ефективні для покращення дистанції ходьби, ніж вправи легкої та середньої інтенсивності, з іншого – вони більш корисні для тренування кардіореспіраторної витривалості. Рекомендація щодо інтенсивних вправ кодифікується як рекомендація класу IIa з рівнем доказовості A. У будь-якому разі тренувальні програми слід розпочинати з вправ низької та середньої інтенсивності та поступово переходити до високоінтенсивних вправ, якщо вони добре переносяться пацієнтом. Такий підхід дає змогу оцінити реакцію пацієнта, підтримати його прихильність до занять і мінімізувати ризик ускладнень. У пацієнтів із симптоматичним ЗПА і погіршенням якості життя, пов'язаного із ЗПА, після 3 місяців оптимальної терапії та лікувальної фізкультури можна розглянути проведення реваскуляризації (IIb, B).
Захворювання аорти Що стосується захворювань аорти, у настанові ESC 2024 року з'явилися нові концепції, що стосуються лікування розширень висхідної аорти, серед яких включення до показань до операції кількох додаткових параметрів, крім діаметра аорти, визнання важливості оцінювання балансу між ризиком аортальних ускладнень та хірургічним ризиком, а також однорідність (хоч і з різними рівнями рекомендацій) показань до операцій у випадку тристулкового (ТСАК) і двостулкового (ДСАК) аортальних клапанів. Аневризма аорти. До ознак високого ризику розриву АГА і АЧА належать: неконтрольована стійка артеріальна гіпертензія – для аневризми кореня, висхідного й низхідного відділів грудної аорти; швидкість збільшення діаметра аорти в зоні аневризми – для всіх видів аневризм (на ≥3 мм на рік за аневризми дуги і висхідного відділу грудної аорти, на ≥10 мм на рік за аневризми низхідного відділу грудної аорти й АЧА); діаметр аорти з поправкою на зріст і вік пацієнта, фенотип розширення аорти «корінь» (розширення на рівні синусів при нормальному розмірі або меншому розширенні тубулярної аорти), довжина висхідного відділу аорти >11 см – для аневризми кореня і висхідного відділу аорти; наявність хронічної обструктивної хвороби легень або мішкоподібної аневризми – для аневризми низхідного відділу грудної аорти; наявність генетичної схильності або специфічних симптомів – для АЧА. Як за ТСАК, так і за ДСАК операція показана, якщо максимальний діаметр аорти становить ≥55 мм (I, B). Тільки для ДСАК операція рекомендована за фенотипу «корінь», якщо максимальний діаметр аорти становить ≥50 мм (I, B). У пацієнтів із ТСАК і низьким хірургічним ризиком (наприклад, <3%) хірургічне лікування пропонується розглядати за діаметра висхідної аорти >52 мм (IIa, B) (рис. 3).
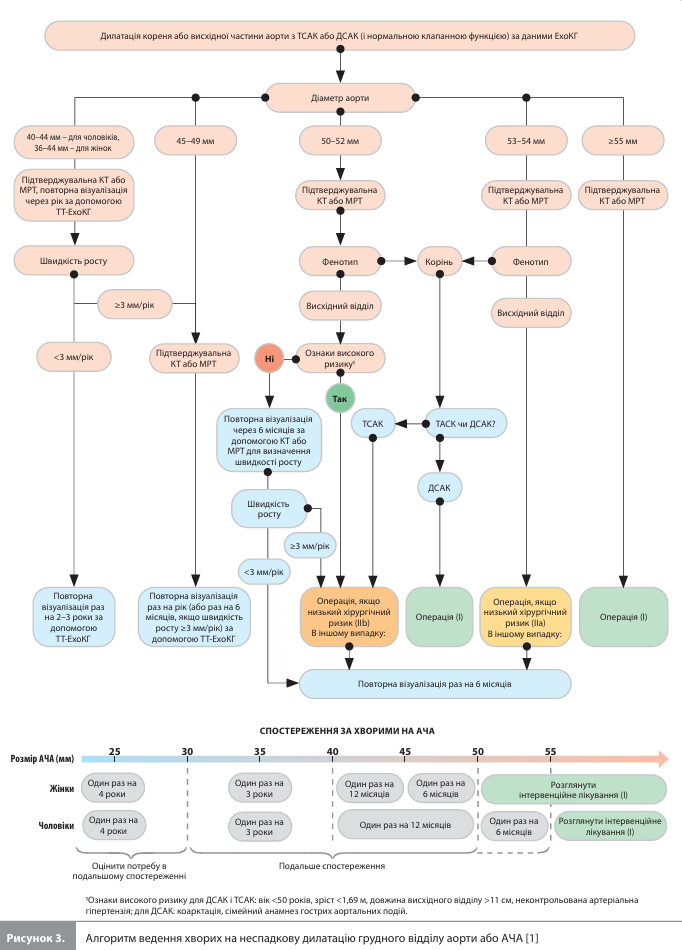
У пацієнтів, які пройшли відкриту операцію на аорті з приводу АЧА, першу контрольну візуалізацію рекомендують провести протягом року після операції і потім повторювати один раз на 5 років (I, А). Після ендоваскулярного втручання на аорті першу контрольну КТ рекомендують провести через місяць, а УЗДС – через 12 місяців і далі один раз на рік (I, А). Розшарування аорти. При підозрі на розшарування аорти рекомендують використовувати багатопараметричний діагностичний алгоритм зі шкалою ризику виявлення розшарування аорти (I, B). Цей алгоритм включає оцінку пацієнтів на наявність станів, характеристик болю та об'єктивних ознак підвищеного ризику. Як метод візуалізації першої лінії рекомендують раннє застосування КТ ділянки від шиї до таза з контрастом і синхронізацією з ЕКГ (I, C). Крім того, рекомендують проведення ЧС-ЕхоКГ, результати якої дають змогу розробити план перед- і післяопераційного лікування і виявити ранні ускладнення (I, C). При ускладненому гострому розшаруванні аорти типу В у пацієнтів зі сприятливою анатомією рекомендують ендоваскулярне втручання (I, B), а як альтернативу – відкриту операцію на аорті (I, B). За тих самих обставин, але за відсутності ускладнень, операцію пропонують проводити після переходу стану в підгостру фазу (IIa, B). Гострий аортальний синдром. Для оцінки гострих аортальних синдромів у новій версії настанови представлена класифікація TEM, де T позначає тип аортального синдрому (А, В, «ні А, ні В»), E – локалізацію вхідного розриву (Е0–Е3), а M – наявність гострої гіпоперфузії та локалізацію її проявів (М0 – немає гіпоперфузії; М1 – гіпоперфузія на рівні коронарного русла; М2 – на рівні супрааортальних стовбурів; М3 – на рівні артерій, що постачають кров'ю спинний мозок, вісцеральних, клубових артерій); усі ці фактори мають прогностичне й терапевтичне значення.
Мультифокальний атеросклероз (МФА) Під МФА розуміють одночасну наявність клінічно значущих обструктивних атеросклеротичних уражень принаймні у двох основних артеріальних басейнах. Він часто зустрічається у пацієнтів з атеросклерозом і незалежно збільшує ризик серйозних СС подій. Хоча клінічна користь систематичного скринінгу на МФА є сумнівною, він може бути корисним для виявлення пацієнтів із високим ризиком подій (або перекваліфікації пацієнтів із проміжним ризиком у групу осіб із високим ризиком СС подій) і прийняття терапевтичних рішень. У цьому контексті пропонується розглядати застосування комбінації ривароксабану (2,5 мг двічі на день) та АСК (100 мг один раз на день) у пацієнтів із симптоматичним МФА, у яких немає високого ризику кровотечі (IIa, A). У пацієнтів із МФА рекомендують зниження концентрації ХС ЛПНЩ на ≥50% від вихідного рівня з досягненням значень <1,4 ммоль/л (<55 мг/дл) одночасно з проактивною корекцією всіх модифікованих чинників ризику за допомогою зміни способу життя і фармакотерапії.
Ризики і прогноз З погляду значущості для СС системи, наявність ЗПА або ХА заслуговує на особливу увагу. Так, пацієнти із ЗПА схильні до високого ризику розвитку серйозних ускладнень із боку кінцівок, включно з реваскуляризацією та ампутацією нижніх кінцівок, які зрештою підвищують ризик смерті. Крім того, ЗПА асоціюється зі значним ураженням сонних артерій і підвищеним ризиком великих несприятливих СС і цереброваскулярних подій (МАСЕ). Тому терапевтичними цілями при ЗПА мають бути покращення якості життя симптоматичних пацієнтів, зниження ризику серйозних ускладнень з боку кінцівок і зменшення загального СС та цереброваскулярного ризику. Наявність АЧА асоціюється з високим СС ризиком, таким самим як при МФА, що призводить до підвищеної смертності серед цих пацієнтів. Дослідження показали, що ізольовані АГА, як правило, мають нижчий профіль СС ризику порівняно з АЧА. Нещодавнє когортне дослідження за участі літніх пацієнтів без попереднього інсульту показало, що великі атеросклеротичні бляшки (завтовшки ≥4 мм) у дузі аорти незалежно асоціюються з підвищенням ризику комбінованої кінцевої точки, що включає ішемічний інсульт, інфаркт міокарда й СС смерть (скориговане відношення ризиків 2,19; 95% довірчий інтервал 1,40–3,43), але не збільшують ризик власне інсульту. Цей висновок дає змогу припустити, що бляшки дуги аорти є, скоріше, маркером СС ризику, а не прямим джерелом емболів, що спричиняють інсульт. Як наслідок, у настанові з’явилася нова рекомендація щодо початку лікування статинами або антитромбоцитарної монотерапії клопідогрелем чи низькою дозою АСК за наявності великих / складних атероматозних бляшок аорти (IIa, C). З огляду на високий СС ризик, характерний для більшості пацієнтів із ЗПА і ХА, експерти ESC визнають значну роль скринінгу на наявність обструктивної ішемічної хвороби серця (ІХС) в оптимізації медикаментозної терапії та плануванні індивідуальних стратегій реваскуляризації. Використання КТ-коронарографії для виявлення обструктивної ІХС дає дуже точну інформацію в більшості пацієнтів із високим СС ризиком і дозволяє швидко й економічно ефективно поставити остаточний діагноз. З організаційного погляду проведення КТ-коронарографії не становить великих проблем, тому що більшість пацієнтів уже проходять КТ грудної клітки і черевної порожнини з контрастом у рамках діагностичного маршруту при ЗПА і ХА. При термінових хірургічних втручаннях, таких як операція з екстреного відновлення кровотоку для порятунку ішемізованої кінцівки, ампутація кінцівки або екстрене втручання на аорті, скринінг на ІХС очевидно відтерміновують, однак у цих випадках необхідна висока настороженість щодо перипроцедурних СС ускладнень. При проведенні планових відкритих операцій, що пов'язані з вищим ризиком перипроцедурних СС ускладнень порівняно з плановими ендоваскулярними втручаннями, вкрай бажано провести передопераційний скринінг на ІХС у пацієнтів без діагнозу обструктивної ІХС. У разі виявлення ознак, що вказують на поєднане / комбіноване ураження судинного русла, необхідно визначитися з термінами й способами лікування обструктивної ІХС і ЗПА/ХА; це рішення слід ухвалювати спільно фахівцями із ЗПА і ХА, кардіологами, інтервенційними кардіологами та кардіохірургами за участі пацієнта. Кінцевою метою є своєчасне й ефективне лікування найбільш клінічно значущих захворювань, що веде до покращення прогнозу та якості життя пацієнта.
Генетичні та вроджені захворювання аорти З огляду на складність і малодоступність обстежень на генетичні захворювання аорти пацієнтам із підозрою на вказані захворювання рекомендують проходити таке тестування в спеціалізованих центрах із великим досвідом його проведення. У настанові подано детальний алгоритм скринінгу на спадкові захворювання грудного відділу аорти. При виявленні осіб зі спадковими захворюваннями грудного відділу аорти рекомендують провести комплексну оцінку всієї аорти та інших ділянок судинного русла. Як методи діагностики спадкового захворювання грудного відділу аорти в пацієнтів і членів їхніх сімей рекомендують використовувати (крім генетичного тестування) такі методи променевої діагностики, як ТТ-ЕхоКГ, СС МРТ або СС КТ. За наявності сильної підозри на наявність генетичного дефекту, не підтвердженого генетичним тестуванням, слід розглянути можливість проведення повторної генетичної оцінки через 3–5 років. Як нововведення представлено конкретні рекомендації з обстеження та хірургічного лікування за синдромів Тернера, Елерса-Данлоса і Лойса-Дітца. Основні рекомендації для пацієнтів із синдромом Марфана стосуються організації спостереження з повторними візуалізаціями, медикаментозної терапії (бета-блокатори або блокатори рецепторів ангіотензину в максимальних переносимих дозах), лікувальної фізкультури й принципів ведення вагітності. Вагоме значення має рекомендація щодо використання нової міжнародної консенсусної номенклатури і класифікації для пацієнтів із двостулковим аортальним клапаном і аортопатією, яка замінює різні використовувані конкуруючі номенклатури. З повним текстом настанови англійською мовою можна ознайомитися на сайті ESC за адресою https://www.escardio.org/.
Список літератури знаходиться в редакції
Автор огляду Микола Горін Medicine Review 2025; 4 (85): 22 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2026. Усі права захищені.
|
мапа сайту корисні посилання |