Вплив вибору статину на ризик серцево-судинних подій: результати спостережного ретроспективного дослідженняЧинна настанова Європейського товариства кардіологів (ESC) щодо профілактики серцево-судинних (СС) захворювань (ССЗ) рекомендує використовувати гіполіпідемічну терапію статинами для корекції рівня холестерину (ХС) ліпопротеїнів низької щільності (ЛПНЩ) і зниження пов'язаних із ним ризиків СС подій і смерті від ССЗ [1]. В іншій настанові ESC, присвяченій корекції атерогенної дисліпідемії, стверджується, що статини покращують клінічний прогноз за всіх (від низького до дуже високого) ступенів СС ризику, а виразність клінічного ефекту залежить передусім від досягненого абсолютного зниження сироваткової концентрації ХС ЛПНЩ [2]. З огляду на це, можна очікувати, що використання потужніших статинів, які знижують рівень ХС ЛПНЩ у середньому на приблизно 50% (таких як розувастатин або аторвастатин), забезпечить більшу клінічну користь у первинній і вторинній профілактиці атеросклеротичних ССЗ. Водночас існують дані, які дають змогу припускати, що зниження СС ризику під впливом статинів зумовлене не тільки корекцією дисліпідемії, а й впливом на неліпідні процеси (наприклад, на запалення та окислювальний стрес [2]), тобто так званими плейотропними ефектами статинів [3]. У зв’язку із цим виник інтерес до того, як саме реалізуються фармакологічні ефекти різних статинів у реальній клінічній практиці та як різні статини впливають на СС наслідки в реальних, не підданих ретельному добору пацієнтів. Одним із дослідницьких проєктів на цю тему стало ретроспективне спостережне нідерландське дослідження Heintjes et al., у якому порівнювали показники частоти госпіталізацій із приводу летальних і нелетальних ССЗ, і зокрема інфаркту міокарда (ІМ), у когорті реальних пацієнтів, які приймали різні статини [4]. Основна інформація про це дослідження стисло подана у статті. 38
Методологія дослідження Heintjes et al. Джерелом даних для цього дослідження стала голландська система PHARMO, що дає змогу зв'язати інформацію про відпуск лікарських препаратів в аптеках із даними про госпіталізацію для понад 3 млн осіб, які на момент проведення дослідження становили близько 12% населення Нідерландів. З огляду на структуру системи PHARMO і принципи реалізації ліків через аптеки, отримана вибірка була репрезентативною для всього населення країни. Крім того, повна компенсація витрат на придбання статинів медичною страховкою і абсолютна обов'язковість медичного страхування в Нідерландах усували ризик спотворення результатів під впливом відмінностей у статусі зайнятості, типі медичної страховки або фінансовому стимулюванні пацієнтів. Аптечні записи містили інформацію про назву препарату, спеціальність лікаря, який виписав рецепт, дату видачі, видану кількість, призначений режим дозування і давали змогу обчислити приблизну тривалість застосування статину. Лікарняні записи містили детальну інформацію про діагнози, проведені процедури, дати госпіталізації, виписки або (у відповідних випадках) внутрішньолікарняної смерті [4]. До досліджуваної вибірки включали пацієнтів віком 18 років і старших, які вперше розпочали приймання статину (розувастатин, аторвастатин, симвастатин, правастатин або флувастатин) упродовж періоду від 1 січня 2000 р. до 30 вересня 2005 р. Дата першої видачі статинів у цей період була датою початку спостереження. Пацієнтів, які протягом року до цієї дати перенесли госпіталізацію з приводу ішемічної хвороби серця (ІХС; включно із черезшкірним коронарним втручанням), цереброваскулярного захворювання (включно із черезшкірною ангіопластикою сонної артерії) або хвороби периферичних артерій, до вибірки не включали. Спостереження припиняли через 2 роки від його початку, або після переїзду чи смерті пацієнта, або 31 грудня 2005 р., або після закінчення першого курсу лікування початково призначеним статином, або в день реєстрації клінічної кінцевої точки (використовували найраніший із цих моментів). Максимальна тривалість спостереження становила два роки [4]. Набір вихідних характеристик учасників дослідження включав стать, вік, супутні захворювання і супутню терапію. Із супутніх захворювань інтерес представляли серцева недостатність, цукровий діабет і артеріальна гіпертензія; із лікарських препаратів – антиаритміки, нітрати, препарати наперстянки, антикоагулянти, антиагреганти і нестатинові гіполіпідемічні препарати. Із відомостей про видачу / застосування статинів витягували такі дані: рік призначення, спеціальність лікаря, який виписав перший препарат (лікар загальної практики або вузький спеціаліст), доза й тривалість приймання статину [4]. Як первинну СС кінцеву точку автори обрали госпіталізацію з приводу ІМ, хронічної ІХС або інсульту, зокрема з проведенням коронарної або каротидної реваскуляризації (сукупно – ССЗ). Вторинною кінцевою точкою була госпіталізація з приводу ІМ. В аналіз включали події, що відбулися під час першого епізоду лікування статинами. Для кожного статину, а також для аторвастатину, симвастатину, правастатину й флувастатину в сукупності розраховували показники захворюваності на ССЗ та ІМ (кількість подій на 100 людино-років [ЛР]) із 95% довірчими інтервалами (ДІ). Далі результати терапії розувастатином порівнювали із сукупним результатом застосування всіх інших статинів, а також із результатом застосування кожного з інших статинів. Результати аналізів представляли у вигляді нескоригованих і скоригованих з урахуванням модифікаторів ефекту відношень ризиків (ВР) із 95% ДІ [4].
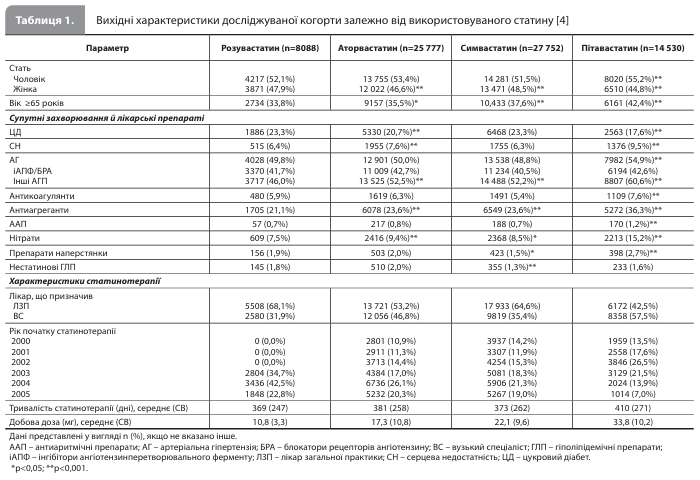
Результати дослідження Heintjes et al. Критеріям включення в дослідження відповідали дані 77 775 пацієнтів, із яких 8088 (10%) приймали розувастатин, 25 777 (33%) – аторвастатин, 27 752 (36%) – симвастатин, 14 530 (19%) – правастатин і 1628 (2%) – флувастатин. У зв'язку з невеликою кількістю пацієнтів, які приймали флувастатин, цей статин виключили з дослідження, унаслідок чого в досліджуваній вибірці залишилися 76 147 пацієнтів [4]. Аналіз вихідних характеристик пацієнтів (табл. 1) показав, що приблизно 35% усіх учасників були старшими за 65 років, водночас у групі правастатину цей показник був вищим від середнього за вибіркою (42%). Більшість пацієнтів (від 43% у групі правастатину до 68% у групі розувастатину) отримали свій перший рецепт на статин від лікаря загальної практики. Частка пацієнтів із СС ризиком, підвищеним через наявність ЦД, варіювалася від 18% у групі правастатину до 23% у групах симвастатину і розувастатину. Кількість пацієнтів, які приймали нітрати (що вказує на наявність атеросклеротичних ССЗ), була значно нижчою в групі розувастатину (8%) порівняно з групами інших статинів (9–15%). Середня тривалість спостереження становила 382 дні (стандартне відхилення [СВ] 261) і варіювалася від 369 у групі розувастатину до 410 днів у групі правастатину. Через 6, 12, 18 і 24 місяці спостереження частки пацієнтів із даними, доступними для аналізу, становили 70, 45, 30 і 20% відповідно [4].
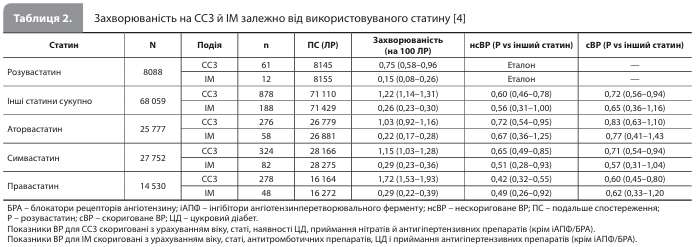
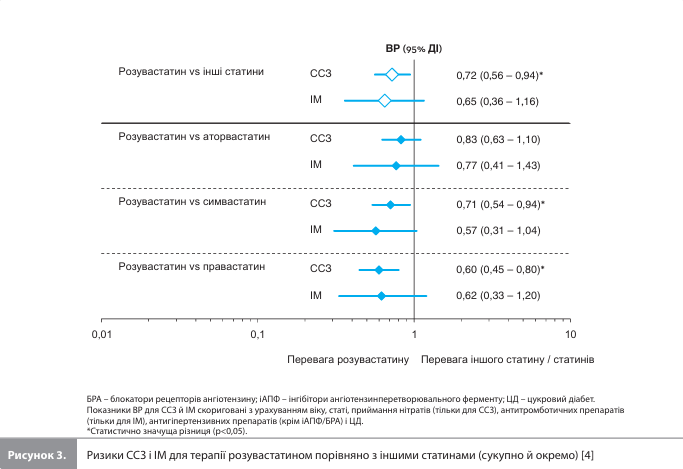
За період спостереження було зареєстровано 939 ССЗ, зокрема 200 ІМ (21%), 312 госпіталізацій з приводу хронічної ІХС (33%) і 427 інсультів (45%). Також були зареєстровані 53 випадки внутрішньолікарняної смерті (табл. 2). За розподілом ІМ, ІХС і інсультів групи статинів були подібними одна до одної, проте криві Каплана-Мейєра показують, що найнижчу частоту ССЗ загалом та ІМ зокрема спостерігали в групі розувастатину (рис. 1, 2). Показники захворюваності на ССЗ та ІМ відповідно варіювалися в діапазоні від 0,75 і 0,15 на 100 ЛР у групі розувастатину до 1,72 і 0,29 на 100 ЛР у групі правастатину. Після коригування з урахуванням модифікаторів ефекту в пацієнтів, які приймали розувастатин, спостерігали нижчу частоту ССЗ, ніж у пацієнтів, які приймали будь-які інші досліджувані статини (ВР 0,72; 95% ДІ 0,56–0,94), а також у пацієнтів із групи симвастатину (ВР 0,71; 0,54–0,94) і пацієнтів із групи правастатину (ВР 0,60; 95% ДІ 0,45–0,80) (табл. 2, рис. 3) [4].


З огляду на те що розувастатин став доступним для широкого використання в Нідерландах лише у 2003 р., автори також провели субаналіз, що включав тільки пацієнтів, які почали статинотерапію у 2003–2005 рр. Порівняння статинів за впливом на ризик ССЗ у цьому субаналізі показало результати, зіставні з результатами основного аналізу (значення ВР для розувастатину vs аторвастатин, симвастатин, правастатин і статини сукупно становили 0,77 [95% ДІ 0,57–1,03], 0,70 [95% ДІ 0,52–0,94], 0,66 [95% ДІ 0,48–0,92] і 0,73 [95% ДІ 0,56–0,95] відповідно) [4].
Обговорення результатів дослідження Heintjes et al. Представлене ретроспективне спостережне дослідження демонструє, що в умовах реальної клінічної практики в пацієнтів, які приймали розувастатин, реєстрували найнижчу частоту ССЗ, порівняно з пацієнтами, які приймали аторвастатин, симвастатин або правастатин (статини перелічені в порядку зростання частоти ССЗ). Після коригування з урахуванням факторів СС ризику, що були різними в групах, які приймали різні статини, приймання розувастатину асоціювалося зі зниженням ризику ССЗ на 28% порівняно із застосуванням інших статинів сукупно, а також на 29% порівняно з прийманням симвастатину й на 40% порівняно з прийманням правастатину. Отримані результати узгоджуються з даними про відносне зниження рівнів ХС ЛПНЩ на тлі використання кожного з досліджуваних статинів. Так, в іншому дослідженні, проведеному авторами на цій самій когорті пацієнтів, виявилося, що за середнього вихідного рівня ХС ЛПНЩ 4,3 ммоль/л найбільше зниження показника спостерігали в групі розувастатину (48%), за ним слідували аторвастатин (42%), симвастатин (39%) і правастатин (32%) [5], що відповідає результатам більш ранніх контрольованих і спостережних досліджень [6–8]. Водночас, на думку Heintjes et al., спостережувані відмінності між ефектами статинів на СС кінцеві точки також можуть пояснюватися проявом у більш ефективних статинів плейотропних властивостей, включно з протизапальними ефектами, а також ефектами, які стабілізують атеросклеротичну бляшку [4]. Це припущення підтримують результати дослідження JUPITER (Justification for the Use of Statins in Prevention: an Intervention Trial Evaluating Rosuvastatin), у якому серед пацієнтів із початково підвищеним рівнем С-реактивного білка й нормальним рівнем ліпідів уже через кілька місяців досліджуваної терапії (розувастатин vs плацебо) стала очевидною міжгрупова різниця за сукупною частотою СС подій на користь розувастатину [9]. Загалом, отримані результати дають змогу припустити, що навіть при застосуванні звичайних доз потужніші статини (розувастатин і аторвастатин), очевидно, мають більш виражений вплив на ризик СС подій у пацієнтів без нещодавніх епізодів ССЗ, аніж симвастатин і правастатин, упродовж перших двох років після початку статинотерапії [4]. До обмежень свого дослідження автори віднесли порівняно невелику тривалість спостереження, а також імовірну наявність неврахованих факторів СС ризику (що характерно для ретроспективних досліджень), а до переваг – пряме порівняння клінічних ефектів чотирьох статинів у широкій реальній вибірці пацієнтів різного віку й статі з дисліпідемією, а також узгодженість одержаних результатів із даними з попередніх досліджень [4].
Висновок Отже, у великій когорті реальних пацієнтів із дисліпідемією, але без нещодавніх СС подій, які вперше почали отримувати терапію стандартними дозами аторвастатину, розувастатину, симвастатину або правастатину й приймали статини впродовж у середньому 55 тижнів, частота ССЗ була найменшою в пацієнтів, які приймали розувастатин. Після коригування з урахуванням факторів СС ризику ризик ССЗ на тлі терапії розувастатином був на 28% нижчим, ніж у сукупній когорті пацієнтів, які приймали інші досліджувані статини.
Список літератури знаходиться в редакції
Автор огляду Галина Мілюхина Medicine Review 2025; 5 (86): 38 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2026. Усі права захищені.
|
мапа сайту корисні посилання |