Консенсусна заява експертів ACC щодо оцінки й лікування кардіогенного шоку: стислий огляд рекомендаційКардіогенний шок (КШ) – це важке, непередбачуване небезпечне для життя ускладнення низки кардіологічних захворювань і, як наслідок, одне з найчастіших показань до госпіталізації у відділення кардіореанімації. Найбільш вивченою формою КШ є такий, що пов'язаний із гострим інфарктом міокарда (ГІМ), проте за останнє десятиліття відзначається зміна структури синдрому в бік збільшення частоти КШ, викликаних іншими причинами, зокрема серцевою недостатністю (СН-КШ). Очевидно, що хворі з різними формами КШ відрізняються за багатьма параметрами, зокрема вихідними характеристиками, супутніми захворюваннями, інтенсивністю використання ресурсів і результатами лікування. Власне лікування КШ досі залишається значною проблемою, оскільки короткострокова смертність при стандартній терапії КШ становить 30–40%, довгострокова (річна) – 50%, а із сучасних методів додаткове зниження смертності переконливо доведено лише для ранньої реваскуляризації при КШ, викликаному ГІМ (ГІМ-КШ). Певні надії також покладаються на використання пристроїв для тимчасової механічної підтримки кровообігу (тМПК), які, за даними досліджень, можуть покращувати виживаність у відібраних хворих із КШ. З огляду на гостру потребу в розробці оптимального підходу до діагностики й лікування КШ, Американський коледж кардіологів (ACC) провів віртуальний круглий стіл Heart House за участю міжнародних експертів і представників різних медичних спеціальностей. Обговорення було присвячено невирішеним питанням раннього виявлення і ведення КШ, оптимального моніторингу гемодинаміки, медикаментозного лікування, застосування тМПК та інтенсивної терапії. Підсумком стало створення клінічних рекомендацій, покликаних допомогти фахівцям в ухваленні клінічних рішень і веденні дорослих пацієнтів із ГІМ-КШ та СН-КШ [1].
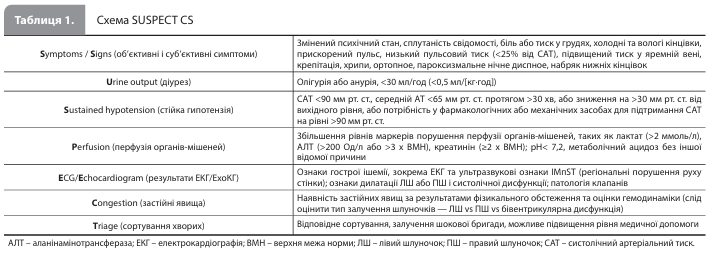
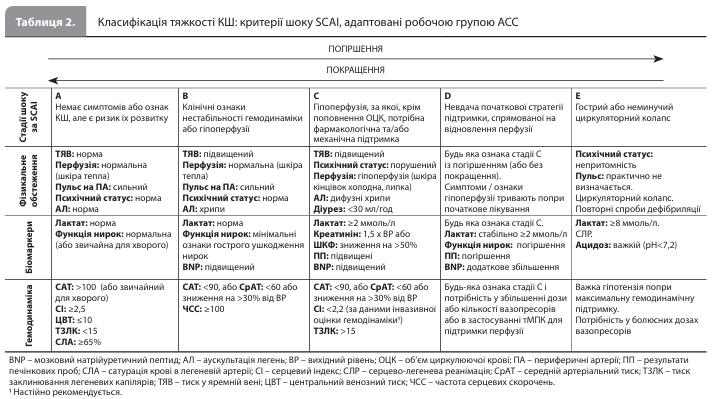
Визначення, критерії Критеріям ГІМ-КШ відповідає КШ, викликаний ГІМ із підйомом і без підйому сегмента ST (ІМпST і ІМбпST відповідно), при цьому в основі ліво-, правошлуночкової або бівентрикулярної дисфункції можуть лежати тривала ішемія або ішемічне ушкодження міокарда, а також механічні ускладнення ГІМ. Слід зазначити, що КШ, викликаний гострою брадиаритмією, тахіаритмією або прогресуючою серцевою блокадою, станом після зупинки серця або будь-якими іншими ускладненнями ГІМ, також класифікується як ГІМ-КШ. СН-КШ є наслідком первинної дисфункції міокарда, спричиненої ішемічною або неішемічною кардіоміопатією. СН-КШ можна поділити на КШ внаслідок de novo СН (тобто гостра дисфункція міокарда, що виникла вперше) і КШ внаслідок гострої декомпенсації СН (тобто гостра декомпенсація хронічної або прогресуючої СН). Як і у випадку з ГІМ-КШ, СН-КШ може бути пов'язаний із лівосторонньою, правосторонньою або двосторонньою (бівентрикулярною) дисфункцією шлуночків. Основними причинами розвитку дисфункції міокарда, що призводить до СН-КШ, є гострий міокардит, кардіоміопатія (КМП) Такоцубо, перипартальна КМП, тахікардична КМП, гіпертрофічна КМП та інфільтративні захворювання серця, зокрема амілоїдоз і саркоїдоз. У таблиці 1 представлений запропонований робочою групою АСС алгоритм дій щодо підтвердження діагнозу КШ (схема SUSPECT CS). У документі підкреслюється, що на етапі первинної підозри й діагностики КШ не потрібно проводити інвазивну оцінку гемодинаміки; проте така оцінка часто допомагає з'ясувати ступінь залучення шлуночків і профіль застійних явищ у пацієнта з КШ і може допомогти в ухваленні терапевтичного рішення. Після постановки діагнозу КШ для оцінки ступеня тяжкості / стадії КШ рекомендується використовувати адаптовану класифікацію SCAI (табл. 2).
Інвазивна оцінка / моніторинг гемодинаміки Інвазивна оцінка / моніторинг гемодинаміки у відділенні інтенсивної кардіологічної терапії є джерелом важливих даних, корисних для визначення фенотипу й оцінки тяжкості КШ, а також для ухвалення рішень про початок і завершення використання тМПК. Прогностична користь катетеризації легеневої артерії при КШ підтверджується даними аналізів ретроспективних даних і багатоцентрових реєстрових досліджень. Зокрема, було показано, що наявність повного профілю гемодинамічних характеристик порівняно з неповним або відсутнім профілем пов'язана з більш низькою внутрішньолікарняною смертністю, а рання інвазивна оцінка гемодинаміки, проведена протягом перших 12 годин, пов'язана з поліпшенням клінічних результатів. Гемодинамічні параметри, асоційовані з підвищеним ризиком смерті при КШ, включають низький середній артеріальний тиск (АТ), підвищений тиск у правому передсерді (ТПП), підвищене співвідношення «ТПП/тиск заклинювання легеневих капілярів» і знижений індекс пульсації легеневої артерії (PAPi, відношення різниці систолічного й діастолічного тиску в легеневій артерії до величини центрального венозного тиску). На думку робочої групи АСС, поєднання інвазивної оцінки гемодинаміки з неінвазивною візуалізацією серця (наприклад, ехокардіографією або УЗД) дозволяє більш точно оцінити фенотип пацієнта з КШ (табл. 3).

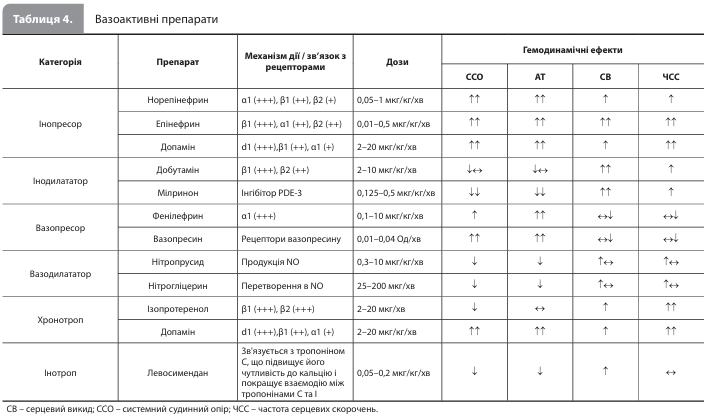
Фармакотерапія КШ Метою фармакотерапії КШ є усунення застійних явищ (за наявності), нормалізація серцевого викиду й поліпшення перфузії життєво важливих органів. За наявності застійного фенотипу використовуються внутрішньовенні (в/в) петльові діуретики, тіазидні діуретики і, за відсутності ефекту від фармакотерапії, замісна ниркова терапія. Персистуючий застій може призвести до мікроциркуляторної ішемії та пошкодження нирок, печінки, шлунково-кишкового тракту й інших органів. Для корекції гіпоперфузії використовуються в/в вазоактивні препарати, зокрема інотропи, хронотропи, інопресори, інодилататори, вазодилататори й вазопресори (табл. 4). Слід пам'ятати, що деякі із цих препаратів пов'язані з підвищеним ризиком розвитку побічних ефектів, у тому числі аритмій і підвищеного споживання кисню міокардом, тому робоча група АСС рекомендує використовувати вазоактивні препарати при КШ у мінімальній дозі, необхідній для підтримки адекватної перфузії, і протягом якомога коротшого періоду часу. Кокранівський метааналіз 2020 р. не виявив достатніх доказів переваги конкретного інотропного або вазодилатуючого засобу при КШ, у тому числі з точки зору зниження смертності. У дослідженні DOREMI (Dobutamine Compared with Milrinone), присвяченому порівнянню добутаміну й мілринону в 192 пацієнтів із КШ (стадії В–Е за класифікацією SCAI), досліджувані препарати не відрізнялися за впливом на первинну кінцеву точку – комбінацію внутрішньолікарняної смерті від будь-якої причини, успішної реанімації після зупинки серця, трансплантації серця, початку механічної підтримки кровообігу, нефатального інфаркту міокарда, транзиторної ішемічної атаки / інсульту й початку замісної ниркової терапії. Проте лікар може оптимізувати терапію конкретного пацієнта з урахуванням особливостей перебігу КШ. Зокрема, використання інодилататорів або вазодилататорів можна розглядати при нормотензивному КШ, особливо у пацієнтів із підвищеним системним судинним опором. В/в мілрінон, з огляду на його відносно тривалий період напіввиведення і ниркову екскрецію, слід розумно використовувати в пацієнтів із погіршенням функції нирок. Хронотропи можуть бути корисні при КШ, викликаному брадикардією. Водночас, оскільки чисті вазопресори (наприклад, фенілефрин) можуть викликати рефлекторну брадикардію і знижувати серцевий викид при КШ, робоча група настійно не рекомендує використовувати їх у якості єдиного препарату першої лінії для безперервного в/в введення. За відсутності чіткого консенсусу щодо вибору вазоактивного препарату першої лінії, фахівці АСС згодні з тим, що введення норадреналіну є обґрунтованим першим вибором для більшості пацієнтів із КШ і гіпотензією. При рефрактерності пацієнта до початкової фармакологічної терапії слід розглядати доцільність його переведення до медичного центру вищого рівня з можливістю проведення тМПК та/або передових методів лікування.
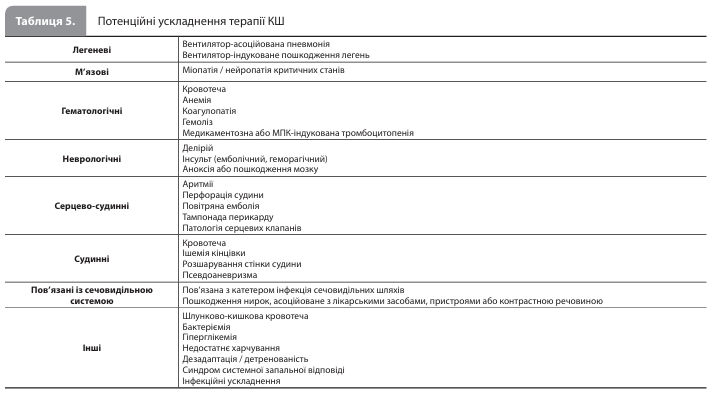
тМПК Рандомізовані клінічні дослідження, які вивчали тМПК при КШ, були в основному зосереджені на пацієнтах з ІМпST і мали обмеження, пов'язані з об'ємом вибірки, дизайном дослідження, критеріями відбору, термінами та іншими ключовими факторами. В умовах дефіциту прямих рандомізованих порівняльних досліджень різних пристроїв для тМПК вибір пристрою має ґрунтуватися на результатах порівняння потенційних терапевтичних переваг із ризиком кровотеч, а також судинних, неврологічних, інфекційних та інших ускладнень (табл. 5).
Хоча тМПК все частіше використовується в лікуванні ГІМ-КШ і СН-КШ, рутинне застосування пристроїв у всіх пацієнтів із КШ настійно не рекомендується. Багатоцентрове рандомізоване відкрите дослідження IABPSHOCK (Intraaortic Balloon Pump in Cardiogenic Shock) II за участю 600 пацієнтів із ГІМ-КШ, які пройшли ранню реваскуляризацію, не виявило розбіжностей між групою внутрішньоаортальної балонної контрпульсації (ВАБК) і контрольною групою, яка отримувала стандартну терапію без ВАБК, за показником 30-денної загальної смертності та результатами 6-річного довгострокового спостереження. Схожі результати були отримані в багатоцентровому рандомізованому відкритому дослідженні ECLS-SHOCK (Extracorporeal Life Support in Infarct-Related Cardiogenic Shock) за участю 420 пацієнтів із ГІМ-КШ і ранньою реваскуляризацією, у яких додавання до фармакотерапії екстракорпоральної мембранної оксигенації (early extracorporeal life support, ECLS) не знижувало рівень 30-денної загальної смертності порівняно з терапією без ECLS. Водночас дослідження DanGer Shock вперше продемонструвало, що раннє (протягом перших 24 годин) використання мікроаксіального насоса в окремих пацієнтів із КШ, пов'язаним з ІМпST, здатне поліпшити 180-денну виживаність порівняно зі стандартним лікуванням: абсолютне зниження смертності становило 12,7%. Проте суворі критерії відбору учасників для DanGer Shock обмежують доказову базу на користь застосування цього пристрою невеликою когортою пацієнтів із КШ, викликаним ІМпST. Метааналіз даних окремих учасників рандомізованих клінічних досліджень із 6-місячним періодом спостереження показав, що в пацієнтів з ІМпST без ризику гіпоксичного ураження головного мозку використання тМПК, зокрема вено-артеріальної екстракорпоральної мембранної оксигенації (ВА-ЕКМО), асоціювалося зі зниженням смертності. Отже, робоча група вважає, що посилення терапії КШ із переходом до тМПК за допомогою мікроаксіального насоса може розглядатись у ретельно відібраних пацієнтів з ІМпST, КШ із переважним ураженням лівого шлуночка за наявності клінічно значущої гіпоперфузії та/або ознак погіршення гемодинаміки. Запропоновані робочою групою АСС стандартизовані алгоритми ведення хворих на ГІМ-КШ і СН-КШ представлені в таблицях 6 і 7.

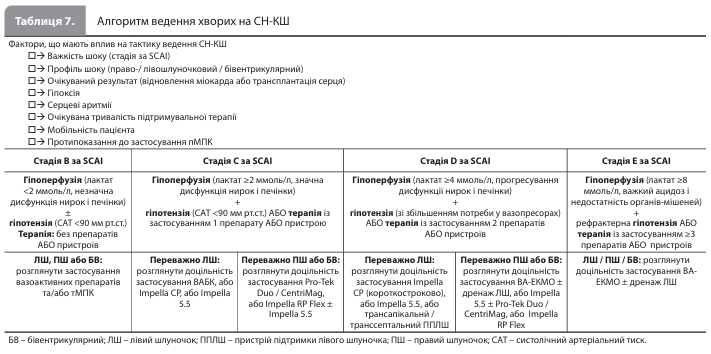
З погляду на механізм дії тМПК, мета її застосування полягає в розвантаженні шлуночків і відновленні системної перфузії, що може сприяти відновленню міокарда або успішному переходу до передових методів лікування. Крім того, використання тМПК може дозволити знизити дози та/ або зменшити тривалість введення препаратів, які можуть посилити пошкодження або ішемію міокарда. У цілому, вибір пристрою для тМПК повинен ґрунтуватися на бажаній величині серцевого індексу, яка забезпечить поліпшення перфузії при недостатній ефективності фармакотерапії. Якщо обраний пристрій для тМПК не забезпечує досягнення цієї мети, допустимий перехід до пристрою тМПК іншого типу (ескалація тМПК). Підвищити ефективність тМПК також дозволяють заходи, спрямовані на зниження постнавантаження, і протизастійна терапія. Пацієнтам із низькими шансами на відновлення міокарда, які не відповідають критеріям переходу до постійної механічної підтримки кровообігу (пМПК) і трансплантації серця, показана рання консультація з питань паліативної допомоги. Затримка початку тМПК у відповідних кандидатів може призвести до погіршення перфузії органів-мішеней, а також до гемодинамічних і метаболічних порушень, які в кінцевому підсумку призводять до поліорганної недостатності та смерті. Тому раннє розпізнавання КШ, швидкий початок індивідуально підібраної тМПК із регулярними повторними оцінками ефективності терапії допомагають поліпшити результати лікування. Поява ознак набряку легенів, стійкого застою, погіршення перфузії та/або поліорганної дисфункції має спонукати фахівців до обговорення питання про ескалацію тМПК. Вирішальне значення мають перші 24 години після постановки діагнозу КШ, при цьому було показано, що за цей період найчастіше погіршується стан у пацієнтів із початковою стадією шоку В за SCAI.
Організація інтенсивної терапії Ключові елементи безперервної інтенсивної терапії КШ включають: 1) послідовну переоцінку показників адекватності гемодинамічної підтримки (табл. 8); 2) лікування оборотних причин КШ; 3) корекцію ускладнень тМПК та інших втручань, які проводяться у відділенні інтенсивної терапії; 4) лікування ушкоджень органів-мішеней, викликаних КШ; 5) якнайшвидшу деескалацію інвазивної терапії; та 6) скоординоване міждисциплінарне ухвалення рішень щодо схеми ведення пацієнта та цілей лікування КШ (відновлення міокарда, передові методи лікування або паліативна допомога). Серед ускладнень інтенсивної терапії КШ (табл. 5) найбільшої уваги вимагають ускладнення в місці судинного доступу, що використовується для підключення пристрою для тМПК, зокрема кровотеча та ішемія кінцівок, розвиток яких значно підвищує ризик смерті. Якщо ухвалено рішення видалити пристрій для тМПК, то при діаметрі катетера ≥12 FR робити це краще в операційній або катетеризаційній лабораторії. Не менш важливим є вибір режиму штучної вентиляції легенів (ШВЛ), оскільки, наприклад, режим позитивного тиску в кінці видиху може по-різному впливати на гемодинамічний статус при різних варіантах КШ.

Рішення про скасування тМПК має ухвалюватися з урахуванням результатів щоденної оцінки гемодинамічної стабільності, поточної загальної потреби пацієнта в підтримці вазоактивними препаратами, волемічного статусу й ефективності заходів щодо усунення / корекції причини КШ. Першим етапом є поступове зменшення швидкості потоку через пристрій, темп якого залежить від типу й оборотності вихідного ушкодження серцево-судинної системи (стандартний варіант: зниження швидкості потоку на 0,5–1 л/хв через кожні 2–4 години). За висновком робочої групи, стандартизований міждисциплінарний підхід до ведення пацієнтів із КШ асоціюється з покращенням результатів лікування і може полегшити перехід пацієнта як у період відновлення міокарда, так і до передової терапії або паліативної допомоги.
Список літератури знаходиться в редакції
Автор огляду Микола Горін Medicine Review 2025; 7 (88): 20 |
Корисні посилання






|
|
Інформація, розміщена на сайті, призначена тільки для професіоналів охорони здоров'я та не може бути використана як інструкція для самолікування. |
Головна | Про видання | Поточний номер | Архів номерів | Новини | Правова інформація
Medicine Review © 2008—2026. Усі права захищені.
|
мапа сайту корисні посилання |